Fattori determinanti il destino del falso lume nelle dissezioni aortiche
F.Siclari, R.Trunfio, J. Van den Berg
Introduzione
La dissezione aortica é una delle patologie letali più frequenti che implicano l’aorta.
La prevalenza stimata è di circa 2 x 100'000 all’anno. Dati autoptici mostrano che la diagnosi pre-decesso aveva potuto essere stabilita in non più del 15% dei pazienti, per cui la vera incidenza dell’evento è sottostimata (1).
Sebbene la dissezione dell’aorta sia un evento acuto, nella maggior parte dei casi è presente una malattia cronica e generalizzata della media della parete aortica che la predispone alla dissezione.
La chirurgia per la dissezione del tipo A si basa sull’eliminazione della sede di entrata sostituendo l’aorta ascendente e evitando così la progressione retrograda della dissezione che può provocare una rottura letale nel pericardio.
L’intervento chirurgico tratta soltanto ciò che la malattia sottostante ha causato (la dissezione) ma non la malattia di per sé. Il potenziale per la formazione dell’aneurisma, la progressiva dilatazione aortica e la redissezione dell’aorta rimanente richiedono un monitoraggio attento a lungo termine dei pazienti.
Fattori clinici
Nel momento in cui la parete aortica è indebolita dalla dissezione un controllo attento della pressione arteriosa è estremamente importante per evitare la progressione della dilatazione aortica.
Un controllo inadeguato della pressione arteriosa o una compliance insufficiente del paziente è significativamente legato ad un aumento del rischio di rottura dopo una dissezione di tipo B (2).
La somministrazione a lungo termine di Beta Bloccanti ha un effetto benefico per evitare un successivo allargamento aortico (3).
La presenza di un lume falso è un fattore che di per sé può predisporre il paziente ad un allargamento progressivo dell’aorta (4,5), probabilmente a causa della diretta attività della pressione sanguigna sulla parete aortica del falso lume che consiste di sola avventizia.
In alcuni casi in cui il falso lume si trombizza e raramente si osserva una regressione della dissezione (6).
Laddove si realizza tuttavia uno squilibrio tra la tensione superficiale e la pressione arteriosa c’é il pericolo che le strutture vascolari siano incapaci di sostenere la pressione con il risultato che l’aneurisma si rompa.
Si è osservato che il riscontro di un ampio diametro dell’aorta all’epoca della diagnosi o dell’intervento predispone l’aorta ad un ulteriore allargamento. Il limite del diametro aortico significativo per una susseguente operazione/rottura è 50mm. Alcuni altri autori indicano che la presenza di un diametro aortico ampio (> di 40mm) e la presenza di un falso lume pervio possono avere un effetto additivo per l’aumento del diametro aortico (7).
Anche il rapporto fra l’area della sezione dell’aorta discendente e l’area del lume falso sia un fattore importante prognostico. Un’area dissezione del falso lume superiore del 70% accompagnata da una successiva dilatazione nel follow up (8).
Eccetto per i pazienti affetti da una debolezza congenita conosciuta della media aortica come ad esempio la sindrome di Marfan (MFS) o quella di Ehlers-Danlos, l’aorta può essere debole a causa di una degenerazione aterosclerotica della parete aortica. Questo è generalmente riscontrato nei pazienti in cui siano presenti multipli fattori di rischio cardiovascolari. Tra questi, l’abuso nicotinico e la malattia polmonare cronica ostruttiva sono stati riscontrati essere dei fattori di rischio significativi per l’ulteriore dilatazione aortica (9).
Fattori biologici
Anche se il meccanismo pato-fisiologico della formazione di un aneurisma non sia ancora stato completamente compreso, sembra che non vi sia una chiara demarcazione tra struttura e funzione della matrice del tessuto connettivo.
La costituzione della parete aortica ricopre un’importanza cardinale per l’evoluzione patologica della parete aortica.
Le fibre elastiche sono particolarmente abbondanti nella matrice extracellulare del tessuto connettivo che va incontro a sollecitazioni dinamiche come le arterie, i polmoni, la pelle ed i legamenti. La loro funzione principale è, da una parte, conferire ai tessuti un rimbalzo elastico, e dall’altra, fornire un’importante superficie di adesione per le cellule nonché regolare la disponibilità di fattori di crescita. Queste fibre sono costituite da elastina e da una rete di microfibrille legate a proteine strutturali e dei polipeptidi chiamati “transforming growth factor b” (TGF-b) (10). Le TGF-b sono una famiglia di polipeptidi multifunzionali che influenzano la crescita, differenziazione, adesione, migrazione e la capacità di sintetizzare matrice di diversi tipi cellulari.
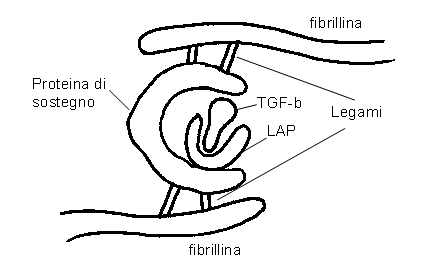
La maggior parte delle cellule che producono TGF-b, secernono questa proteina in una forma inattiva, associata con un propeptide (chiamato “latency associated peptide” = LAP) che insieme formano il “small latent complex” (SLC) (11) – fig. 1.
Per esercitare gli effetti cellulari il TGF-b deve essere dissociato dal LAP per connettersi al recettore.
L’aspetto più rilevante di questo meccanismo complesso é il TGF-b che, una volta persa l’integrità strutturale, é in grado di legarsi ai recettori di superficie di varie cellule stimolando la produzione di collagene e altre proteine.
Poiché il rimodellamento del tessuto connettivo è un processo complesso, una certa attività proteolitica è necessaria. Tale attività sembra in gran parte essere mediata dalle metalloproteinasi la cui attivazione è indotta dal TGF-b.
Le metalloproteinasi (MMPs) sono una famiglia d’enzimi necessari per la degradazione della matrice extracellulare durante i processi embrionali di sviluppo, morfogenesi e rimodellamento tissutale. La MMP-9 può essere particolarmente rilevante nell’irrigidimento delle grosse arterie associate con una malattia vascolare.
L’elevata espressione della MMP-9 è stata associata con la formazione di aneurismi. Tale fenomeno presumibilmente avviene quale conseguenza dell’eccessiva degradazione di componenti della matrice extracellulare.
Poiché le proprietà elastiche dell’arteria sono fornite primariamente dalla matrice, è plausibile che un’eccessiva degradazione per rimodellamento della matrice elastica, associata con un aumento di MMP-9, risulti in un irrigidimento della parete vascolare.
La MFS è un disordine autosomico dominante legato al gene della fibrillina 1 sul cromosoma 15. Questa sindrome è caratterizzata da anomalie scheletriche, oculari e cardiovascolari. In presenza di una fibrillina anomala il legame con il complesso contenente il TGF-b é più instabile permettendo una liberazione facilitata della componente attiva (12).
Alcune manifestazioni dell’MSF riflettono l’eccessiva attività della famiglia di citochine TGF-b.
In un modello murino di MFS l’aumentata produzione di TGF-b può essere prevenuta da antagonisti mirati del TGF-b come degli anticorpi ad esso diretti o mediante dei bloccanti del recettore dell’angiotensina tipo I (AT1).
Gli AT1 antagonisti possono anche parzialmente rendere reversibili le manifestazioni non cardiovascolari dell’MFS. Questi dati suggeriscono che il Losartan, un farmaco già in uso clinico per l’ipertensione, possa giocare un ruolo importante come strategia terapeutica nei pazienti con MFS e abbia il potenziale di prevenire le importanti e gravi manifestazioni di questo disordine (13).
Sbilanci tra le MMPS e i loro inibitori endogeni (TIMPs) sono stati riscontrati essere responsabili della formazione d’aneurismi. Nei pazienti con un’aorta dilatata i livelli plasmatici di MMP9 tendono ad essere più alti che in pazienti senza dilatazione, mentre un intervento chirurgico generalmente porta ad un improvviso aumento di livelli MMP9.
Tale aumento è stato anche osservato durante il follow up di pazienti in terapia medica dopo una dissezione di tipo B, il che probabilmente indica un rimodellamento attivo della parete aortica (14).
Le diminuite proprietà elastiche dell’aorta sono state descritte in pazienti affetti da MFS, mediante analisi ecocardiografiche. Tali pazienti mostrano una diminuita distensibilità aortica, un aumentato indice di rigidità di parete, un minor aumento del diametro sistolico e un minor aumento dell’area sistolica.
Pazienti che ricevono Enalapril, un potente inibitore dell’enzima convertente l’angiotensina, hanno mostrato un rilevante miglioramento degli indici di rigidità di parete rispetto a chi riceveva i betabloccanti (15).
Un’interessante somiglianza in quantità e qualità delle proteine secrete e nel grado di apoptosi delle cellule muscolari liscie della parete vascolare è stata trovata sia in pazienti affetti da MFS ed in pazienti con bicuspidia valvolare aortica (BAV). L’osservata alta incidenza in ambedue i gruppi di pazienti d’aneurisma dell’aorta ascendente e morte prematura può suggerire la presenza di un’anomalia cellulare fondamentale nei pazienti con BAV possibilmente di origine genetica (16).
Destino finale comune
Sembra che errori genetici come nel caso di pazienti affetti da MFS così come lesioni aortiche acquisite (infiammatorie, aterosclerotiche o indotte da tossina: ad es. nicotina) dell’aorta possono condividere un destino finale comune.
Questo porta alla perdita della componente elastica della parete aortica con susseguente rigidità e risultante diminuita capacità di adattarsi all’impatto dell’onda pressoria sanguigna.
Anche se il rimodellamento della matrice extracellulare può essere differente tra pazienti MFS e non-MFS (17), dal punto di vista biologico sembra tuttavia che in ambedue i casi la forte iperespressione di TGF-b induca l’attività delle metalloproteinasi (MMP-9), che a loro volta promuovono la degradazione della matrice extracellulare.
Marcatori plasmatici
Alcuni studi hanno descritto un marcatore biologico plasmatico per la dissezione aortica. L’estensivo danno subito dalla parete aortica durante la dissezione porta alla distruzione di cellule muscolari lisce della media. Il rilascio delle proteine strutturali di tali cellule è la base per il test diagnostico (18). È stato sviluppato un test immunologico capace di scoprire nel siero le catene pesanti della miosina del muscolo liscio (SSMMHC). Questo potrebbe rappresentare uno strumento valido per la scoperta precoce della dissezione aortica. La SSMMHC aumenta rapidamente nelle prime 6 ore dopo l’inizio della dissezione e non vi è una reazione crociata con il muscolo scheletrico o cardiaco. Il normale livello serico è di 0.9 ± 0.4 µg/L. Livelli al di sopra di 2,5 µg/L sono considerati patologici. I livelli medi in pazienti con dissezione acuti dell’aorta sono stati riportati essere compresi fra 22 e 51 µg /L. Livelli più alti di SSMMHC sono stati osservati nelle dissezioni toraciche rispetto a quelle addominali, probabilmente riflettendo il diverso contenuto di cellule muscolari lisce delle due porzioni aortiche.
La sensitività è stata del 91% e la specificità del 98% nelle prime 3 ore dopo l’evento acuto, per poi diminuire. Dal momento che il tempo richiesto per il test è solo di 30 minuti possiamo contare su un metodo di diagnosi biochimica rapido e non invasivo per la dissezione acuta dell’aorta.
Quando questo test sarà perfezionato e diventa ottenibile commercialmente, può diventare un utile passo iniziale nell’individuare pazienti con dissezione aortica sempre che essi si presentino entro 6 ore, preferibilmente entro 3 ore, dall’inizio dei sintomi. Il test può anche essere utile nel giudicare la necessità e l’urgenza di eseguire successive procedure diagnostiche.
Un importante aumento è anche riscontrabile nella fase subacuta di pazienti trattati conservativamente, affetti da dissezione aortica di tipo B. Ciò rifletterebbe l’espressione di un rimodellamento aortico in corso. Un aumento dell’attività proteolitica potrebbe accompagnare i tentativi dell’aorta dissecata di guarire, ma un tale fenomeno può indebolire ulteriormente la parete aortica, predisponendola alla dilatazione o alla rottura (19).
Conclusioni
Il comportamento del falso lume dopo una dissezione aortica può essere anticipato da osservazione clinica e in un prossimo futuro da esami biochimici. Bisogna porre particolare attenzione ai controlli periodici dei pazienti che abbiano un diametro dell’aorta superiore ai 40 mm all’epoca della dissezione o abbiano un’area sezionale del falso lume superiore al 70% dell’intera aorta. Un importante fattore prognostico è la compliance dei pazienti nel controllo della pressione sanguigna. I bloccanti dei recettori AT1 ed i farmaci inibitori dell’enzima convertente l’angiotensina possono essere un modo importante di inibire l’’iperespressione di TGF-b ed essere in grado di rallentare, fermare, o addirittura far regredire la dilatazione aortica. Il nuovo test SSMMHC può essere uno strumento valido per la diagnosi e monitoraggio dell’aorta dissecata. Nuove conoscenze acquisite dalla ricerca di base sui meccanismi regolatori responsabili per l’omeostasi del tessuto connettivo, potranno fornirci test diagnostici più efficaci. Si potrebbe addirittura ipotizzare una serie di misure terapeutiche, basate sulla nuova conoscenza degli aspetti biochimici e genetici della malattia.
1. Hagan PG, Nienaber CA, Isselbacher EM, et al. The International Registry of Acute Aortic Dissection (IRAD): new insights into an old disease. Jama 2000;283(7):897-903.
2. Onitsuka S, Akashi H, Tayama K, et al. Long-term outcome and prognostic predictors of medically treated acute type B aortic dissections. Ann Thorac Surg 2004;78(4):1268-73.
3. Genoni M, Paul M, Jenni R, Graves K, Seifert B, Turina M. Chronic beta-blocker therapy improves outcome and reduces treatment costs in chronic type B aortic dissection. Eur J Cardiothorac Surg 2001;19(5):606-10.
4. Sueyoshi E, Sakamoto I, Hayashi K, Yamaguchi T, Imada T. Growth rate of aortic diameter in patients with type B aortic dissection during the chronic phase. Circulation 2004;110(11 Suppl 1):II256-61.
5. Akutsu K, Nejima J, Kiuchi K, et al. Effects of the patent false lumen on the long-term outcome of type B acute aortic dissection. Eur J Cardiothorac Surg 2004;26(2):359-66.
6. Spittell PC, Spittell JA, Jr., Joyce JW, et al. Clinical features and differential diagnosis of aortic dissection: experience with 236 cases (1980 through 1990). Mayo Clin Proc 1993;68(7):642-51.
7. Marui A, Mochizuki T, Mitsui N, Koyama T, Kimura F, Horibe M. Toward the best treatment for uncomplicated patients with type B acute aortic dissection: A consideration for sound surgical indication. Circulation 1999;100(19 Suppl):II275-80.
8. Immer FF, Krahenbuhl E, Hagen U, et al. Large area of the false lumen favors secondary dilatation of the aorta after acute type A aortic dissection. Circulation 2005;112(9 Suppl):I249-52.
9. Estrera AL, Miller CC, 3rd, Safi HJ, et al. Outcomes of medical management of acute type B aortic dissection. Circulation 2006;114(1 Suppl):I384-9.
10. Kanzaki T, Olofsson A, Moren A, et al. TGF-beta 1 binding protein: a component of the large latent complex of TGF-beta 1 with multiple repeat sequences. Cell 1990;61(6):1051-61.
11. Chaudhry SS, Cain SA, Morgan A, Dallas SL, Shuttleworth CA, Kielty CM. Fibrillin-1 regulates the bioavailability of TGF{beta}1. J Cell Biol 2007;176(3):355-67.
12. Dietz HC, Cutting GR, Pyeritz RE, et al. Marfan syndrome caused by a recurrent de novo missense mutation in the fibrillin gene. Nature 1991;352(6333):337-9.
13. Habashi JP, Judge DP, Holm TM, et al. Losartan, an AT1 antagonist, prevents aortic aneurysm in a mouse model of Marfan syndrome. Science 2006;312(5770):117-21.
14. Watanabe T, Sato A, Sawai T, et al. The elevated level of circulating matrix metalloproteinase-9 in patients with abdominal aortic aneurysms decreased to levels equal to those of healthy controls after an aortic repair. Ann Vasc Surg 2006;20(3):317-21.
15. Yetman AT, Bornemeier RA, McCrindle BW. Usefulness of enalapril versus propranolol or atenolol for prevention of aortic dilation in patients with the Marfan syndrome. Am J Cardiol 2005;95(9):1125-7.
16. Nataatmadja M, West M, West J, et al. Abnormal extracellular matrix protein transport associated with increased apoptosis of vascular smooth muscle cells in marfan syndrome and bicuspid aortic valve thoracic aortic aneurysm. Circulation 2003;108 Suppl 1:II329-34.
17. Ikonomidis JS, Jones JA, Barbour JR, et al. Expression of matrix metalloproteinases and endogenous inhibitors within ascending aortic aneurysms of patients with Marfan syndrome. Circulation 2006;114(1 Suppl):I365-70.
18. Suzuki T, Katoh H, Tsuchio Y, et al. Diagnostic implications of elevated levels of smooth-muscle myosin heavy-chain protein in acute aortic dissection. The smooth muscle myosin heavy chain study. Ann Intern Med 2000;133(7):537-41.
19.Sangiorgi G, Trimarchi S, Mauriello A, et al. Plasma levels of metalloproteinases-9 and -2 in the acute and subacute phases of type A and type B aortic dissection. J Cardiovasc Med (Hagerstown) 2006;7(5):307-15.
CONFIGURAZIONE SPAZIALE DEL COMPLESSO TGF-b E FIBRILLINA
