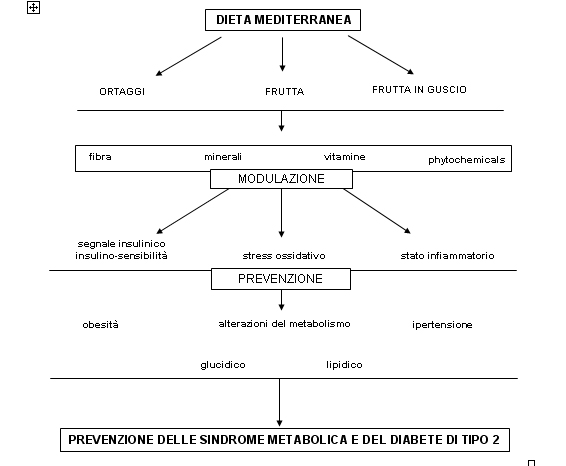
 (figura 1)
(2, 3, 4)
(figura 1)
(2, 3, 4)FRUTTA, ORTAGGI E SINDROME METABOLICA
A. Pinto
INTRODUZIONE
Il ruolo della Dieta Mediterranea (DM), quale “whole diet approach”, nella prevenzione della Sindrome Metabolica (SM) e del Diabete Mellito di tipo 2 (DM2) è supportato da numerose evidenze scientifiche, mentre minore è il numero di studi che analizza selettivamente il ruolo della frutta e degli ortaggi. L’importanza di tale categoria di alimenti, tuttavia, può essere ragionevolmente ipotizzata in funzione del “peso relativo” che assume nell’ambito della DM (in associazione ai cereali, frutta e ortaggi apportano ~ 70% dell’energia totale della dieta, al netto dell’alcol). Recentemente Trichopoulou A. e coll. (2009) hanno analizzato, in un campione di popolazione greca (nell’ambito dello studio EPIC, European Prospective Investigation into Cancer and nutrition), il contributo relativo dei singoli gruppi di alimenti alla riduzione della mortalità per tumori e malattie cardiovascolari: il ruolo principale è stato attribuito all’elevata assunzione di ortaggi, frutta, frutta in guscio, olio d’oliva e legumi, seguito dal basso consumo di carne e derivati e dalla moderata assunzione di vino ai pasti.(1)
1. PHYTOCHEMICALS: dalla tavola alla biologia molecolare.
Molte proprietà della DM sono riconducibili all’apporto di composti funzionali (phytochemicals) presenti negli ortaggi e nella frutta, compresa la frutta in guscio, che interagiscono con alcuni dei meccanismi patogenetici associati alla SM: stress ossidativo, infiammazione e insulino-resistenza (IR).
 (figura 1)
(2, 3, 4)
(figura 1)
(2, 3, 4)
Tali effetti sono stati, in parte, attribuiti ai polifenoli (PF), composti largamente rappresentati nel mondo vegetale. Si conoscono oltre 500 molecole appartenenti a questa categoria, che possono essere raggruppate in 5 classi: flavonoidi, acidi fenolici, alcoli fenolici, stibeni e lignani. (tabella 1)
TABELLA 1 – POLIFENOLI: classi, principali molecole e fonti alimentari
|
POLIFENOLI oltre 500 composti suddivisi in 5 classi |
PRINCIPALI MOLECOLE E FONTI ALIMENTARI |
|
|
1. FLAVONOIDI |
Flavonoli: quercetina, kaempferolo |
cipolle, cavolo riccio, porri, broccoli, mirtilli, tè, vino rosso |
|
Flavoni: apigenina, luteolina |
prezzemolo, sedano |
|
|
Flavanoni: naringenina, esperetina, eriodictiolo |
agrumi, pomodori, menta |
|
|
Isoflavoni: genisteina, daidzeina, gliciteina |
leguminose, soprattutto soia |
|
|
Antocianine: cianidina |
frutti di bosco, fragole, vino rosso, cereali ed ortaggi di colore rosso |
|
|
Flavanoli: catechine e tannini |
albicocche, ciliegie, tè verde, cioccolato, vino rosso, birra |
|
|
2. ACIDI FENOLICI |
Ac. idrossibenzoici: ac gallico, ac. protocatecuico |
more, lamponi, tè, cipolle, caffè, vari frutti, cereali |
|
ac. idrossicinnamici: ac cumarico, ac. caffeico, ac, ferulico |
||
|
3. ALCOLI FENOLICI |
tirosolo, idrossitirosolo, oleuropeina |
olio extravergine d’oliva |
|
4. STILBENI |
resveratrolo |
vino rosso |
|
5. LIGNANI |
secoisola riciresinolo |
semi di lino |
I PF possono influenzare il metabolismo glucidico a vari livelli: digestione e assorbimento dei carboidrati, secrezione e sensibilità insulinica, modulazione dell’output epatico di glucosio. Flavonoidi, acidi fenolici e tannini, in vitro, sono in grado di inibire l’α-amilasi e l’α-glucosidasi intestinali; flavonoidi ed acidi fenolici inibiscono il trasporto del glucosio mediato da SGLT1 e GLUT2. Queste funzioni possono contribuire a modulare il picco glicemico dopo ingestione di amido e/o saccarosio, ma sono necessari ulteriori studi in vivo per confermare tale ipotesi. Analogamente è stata dimostrata, in vitro, la capacità di promuovere la secrezione insulinica glucosio-indotta: l’epigallocatechina gallato (EGCG; contenuta per es. nel tè) e la rutina (arancio, pompelmo, grano saraceno, vino rosso, menta piperita) aumentano la concentrazione β-cellulare di ATP, amplificando il segnale secretagogo del glucosio.
Alcuni composti possono influenzare l’omeostasi glicemica stimolando l’uptake del glucosio, mediato dai GLUT4 e GLUT1, nei tessuti insulino-dipendenti (muscolo e tessuto adiposo), attraverso un meccanismo che coinvolgerebbe la PI-K3 (fosfatidil-inositolo-3-kinasi), e/o riducendo la secrezione epatica del glucosio, sopprimendo l’espressione di enzimi neoglucogenici o aumentando l’attività della glucochinasi, che favorisce la glicogenosintesi e l’utilizzazione intracellulare del glucosio. L’EGCG e la teaflavina svolgerebbero tali funzioni attraverso attivazione dell’AMPK (5' AMP-activated protein kinase) con soppressione della gluconeogenesi epatica e attivazione della β-ossidazione, a cui segue un miglioramento dell’utilizzazione epatica del glucosio e della sensibilità insulinica. (figura 2)
FIGURA 2 - POTENZIALI SITI D’AZIONE DEI POLIFENOLI NELLA REGOLAZIONE
DEL METABOLISMO DEI CARBOIDRATI E DELL’OMEOSTASI GLICEMICA
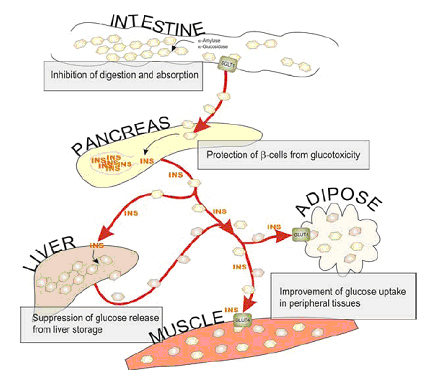
Da: Hanhineva K, Törrönen R, Bondia-Pons I, Pekkinen J, Kolehmainen M, Mykkänen H, Poutanen K. Impact of dietary polyphenols on carbohydrate metabolism. Int J Mol. Sci. 2010 Mar 31;11(4):1365-402
Studi in vivo hanno, inoltre, dimostrato variazioni del contenuto epatico e dei livelli plasmatici dei trigliceridi (TG).
Relativamente pochi sono gli studi che hanno analizzato l’efficacia di singoli PF nella prevenzione del DM2 ed i risultati non sono univoci. Al contrario, sembra dimostrata la relazione inversa tra rischio di DM2 e dieta ricca in PF, lasciando ipotizzare che tale effetto dipende dalle reciproche interazioni e sinergie tra le diverse molecole. È, quindi, emersa la necessità di considerare la dieta nella sua globalità, piuttosto che le singole molecole.(5)
La SM, come il DM2 e spesso l’obesità, risulta caratterizzata dalla presenza di uno stato infiammatorio sistemico cronico di grado moderato, che in associazione agli altri fattori di rischio, contribuisce ad aumentare il rischio di morbilità e mortalità cardiovascolare. Esmaillzadeh A. e col (2006) hanno analizzato la relazione tra assunzione di frutta ed ortaggi, livelli plasmatici di PCR e prevalenza di SM (definita in base ai criteri NCEP-ATP III) attraverso uno studio trasversale condotto su un campione di donne di età 40-60 anni (Tehran, Iran). L’apporto medio di frutta (mele, melone, anguria, uva e banane) e di ortaggi (cipolle, pomodori, verdure miste, lattuga, cetrioli, fagiolini) era rispettivamente di 228 ± 79 g e di 186 ± 88 g/die. Sia l’assunzione della frutta che degli ortaggi è risultata inversamente correlata alla concentrazione plasmatica della PCR, anche dopo analisi multivariata. Il rischio di SM tra i soggetti che appartenevano al quintile più alto di assunzione di frutta e di ortaggi, risultava ridotto rispettivamente del 34% e del 30%, e la riduzione raggiungeva il 39% considerando insieme i due gruppi di alimenti.(4)
Anche in questo caso sarebbero chiamati in causa i PF. Questi composti svolgono importanti attività antiinfiammatorie, modulando l’espressione di alcuni geni coinvolti nel pathway molecolare dell’infiammazione, quali ciclossigenasi, lipossigenasi, sintetasi dell’ossido nitrico ed alcune citochine. Tali effetti sarebbero mediati dall’interazione con il fattore di trascrizione NF-kb (nuclear factor-kappa B) e la Mitogen-Activated Protein Kinase (MAPK), che regolano espressione genica, mitosi, differenziazione, proliferazione ed apoptosi cellulare. Tuttavia, gli effetti non sono sempre prevedibili, variando in relazione ai diversi tipi cellulari, condizioni patologiche e stimolo applicato.(6)
Un ulteriore aspetto riguarda le proprietà antiossidanti dei PF, condivise e associate a quelle di altri composti (quali vitamine e minerali) largamente rappresentati nella frutta e negli ortaggi. Sia l’iperglicemia che l’infiammazione aumentano la produzione di specie reattive dell’ossigeno (ROS) a cui consegue un aumento dello stress ossidativo con iperattività della NADPH ossidasi (responsabile della produzione di anione superossido, O-2). Mentre in condizioni normali la produzione di ossido nitrico (NO) eccede quella di O-2, rapidamente neutralizzato dai sistemi antiossidanti, in caso di disfunzione endoteliale, come nella SM, la produzione endoteliale di NO è ridotta e l’O-2 può dare il via alla cascata dei ROS che porta all’ossidazione di carboidrati, lipidi e proteine. In condizioni fisiologiche, le cellule sono dotate di un complesso sistema di difesa contro il danno ossidativo, associato a fattori enzimatici (superossido dismutasi, catalasi, glutatione perossidasi) e non enzimatici (vitamina E e C). Il sistema antiossidante totale è significativamente depresso nella SM, ed il grado di compromissione è direttamente correlato al numero di sintomi e segni associati alla SM: diabete mellito, ipertensione, obesità, dislipidemia e status infiammatorio. La capacità antiossidante totale (TAC) plasmatica è maggiore, in media di ~ 11%, tra i soggetti che presentano un più alto score di adesione alla DM, e risulta correlata positivamente al consumo di olio di oliva, frutta ed ortaggi, ed inversamente all’assunzione di carne rossa.(7) Il vino rosso, insieme ad altri derivati dell’uva, ricchi in polifenoli (resveratrolo), oltre a contrastare i processi ossidativi determina vasodilatazione endotelio-dipendente, attraverso la produzione di NO, che antagonizza l’attività vasocostrittrice delle endoteline.(2)
2. FRUTTA, ORTAGGI e SINDROME METABOLICA: evidenze scientifiche
Recentemente Carter P. e coll (2010) hanno effettuato una revisione sistematica ed una metanalisi della letteratura per verificare l’impatto del consumo di frutta e ortaggi sull’incidenza di DM2. Sono stati selezionati studi prospettici di coorte in cui veniva valutata l’assunzione di frutta e ortaggi, separatamente o in associazione: solo 6 studi rispondevano ai criteri di inclusione e di questi, 4 fornivano informazioni indipendenti sul consumo di ortaggi a foglia verde. Nell’insieme il maggior consumo di ortaggi a foglia verde risultava associato ad una riduzione del 14% del rischio di DM2, mentre dalla metanalisi non emergeva alcuna significativa riduzione in rapporto all’assunzione di ortaggi e frutta separatamente o in associazione, pur essendo stato rilevato un trend favorevole. Gli Autori hanno evidenziato un’elevata eterogeneità metodologica tra i diversi studi: classificazione dei vegetali, metodi utilizzati per registrare i consumi, distribuzione in centili dei livelli di assunzione, etc. Tuttavia, concludono affermando che un aumento dell’assunzione di ortaggi a foglia verde può ridurre significativamente il rischio di DM2, effetto che dovrebbe essere ulteriormente indagato, e sottolineano l’importanza di considerare gli alimenti nella loro interezza, piuttosto che singoli composto.(8)
3. CONCLUSIONI
Il ruolo degli ortaggi e della frutta nella prevenzione e nel trattamento dietoterapico della SM è supportato da numerose evidenze sperimentali, che derivano da studi in vitro ed in vivo su modelli animali. Meno univoci sono i risultati di studi clinici condotti sull’uomo, in relazione alla mancanza di uniformità metodologica ed alla difficoltà oggettiva di discriminare l’effetto selettivo della frutta e degli ortaggi, singolarmente o in associazione, dalla DM nella sua globalità. L’identificazione dei siti di interazione dei diversi phytochemicals, in particolare PF, con i pathways molecolari associati alla trasmissione del segnale insulinico e, quindi, alla modulazione della sensibilità insulinica, allo stress ossidativo e all’infiammazione, in associazione all’apporto di fibra, vitamine antiossidanti (vit. C e carotenoidi) e minerali (Mg, K), pone tuttavia le basi per la formulazione di un solido razionale a favore del ruolo di questi alimenti. Tuttavia, questi effetti, più che ai singoli composti, sarebbero dovuti alla loro reciproca interazione e sinergia, a conferma del fatto che la DM dev’essere considerata nella sua globalità, quale “whole diet approach”.
BIBLIOGRAFIA
1. Trichopoulou A, Bamia C, Trichopoulos D. Anatomy of health effects of Mediterranean diet: Greek EPIC prospective cohort study. BMJ. 2009 Jun 23;338:b2337.
2. Ortega RM. Importance of functional foods in the Mediterranean diet. Public Health Nutr. 2006 Dec;9(8A):1136-40
3. Serra-Majem L, Roman B, Estruch R. Scientific evidence of interventions using the Mediterranean diet: a systematic review. Nutr Rev. 2006 Feb;64(2 Pt 2):S27-47;
4. Esmaillzadeh A, Kimiagar M, Mehrabi Y, Azadbakht L, Hu FB, Willett WC. Fruit and vegetable intakes, C-reactive protein, and the metabolic syndrome. Am J Clin Nutr. 2006 Dec;84(6):1489-97.
5. Hanhineva K, Törrönen R, Bondia-Pons I, Pekkinen J, Kolehmainen M, Mykkänen H, Poutanen K. Impact of dietary polyphenols on carbohydrate metabolism. Int J Mol. Sci. 2010 Mar 31;11(4):1365-402
6. Santangelo C, Varì R, Scazzocchio B, Di Benedetto R, Filesi C, Masella R. Polyphenols, intracellular signalling and inflammation. Ann Ist Super Sanità. 2007;43(4):394-405
7. Hopps E, Noto D, Caimi G, Averna MR. A novel component of the metabolic syndrome: the oxidative stress. Nutr Metab Cardiovasc Dis. 2010 Jan;20(1):72-7
8. Carter P, Gray LJ, Troughton J, Khunti K, Davies MJ. Fruit and vegetable intake and incidence of type 2 diabetes mellitus: systematic review and meta-analysis. BMJ. 2010 Aug 18;341:c422
- Indirizzo per la corrispondenza Prof. Alessandro Pinto, e-mail: alessandro.pinto@uniroma1.it