 Tab.
1
Tab.
1La gestione del cardioembolismo
G. Minardi, P. Mattacola
Gli emboli provenienti dal cuore o dall’aorta possono distribuirsi in ogni distretto dell’organismo. Negli ultimi anni l’attenzione dei medici si è concentrata, in modo particolare, sullo stroke cardioembolico a causa delle notevoli implicazioni cliniche, prognostiche, economiche e sociali delle sue frequenti conseguenze ed esiti; anche altre sedi di cardioembolismo sono tuttavia molto rilevanti, sia quando le conseguenze sono apprezzabili sul piano clinico e sintomatologico (embolie agli arti, all’intestino etc), sia quando sono pauci-asintomatiche (embolie spleniche etc). Il coinvolgimento dello specialista cardiologo è aumentato grazie al sempre maggior utilizzo di metodiche diagnostiche strumentali cardiologiche, prima fra tutte l’ecocardiografia, cosicchè il ruolo del cardiologo è diventato sempre più rilevante per la diagnosi, per l’indirizzo terapeutico specifico e per le misure di prevenzione delle recidive. Trattandosi di tromboembolismo nell’ambito di patologie vascolari cerebrali, verrà trattato in particolare il ruolo e la gestione del cardioembolismo.
Una genesi cardioembolica certa di un evento ischemico cerebrale può essere sospettata quando: 1) il quadro clinico e radiologico di infarto cerebrale sono compatibili con una fonte embolica prossimale; 2) é presente un’anomalia cardiaca potenzialmente emboligena (Tab 1, 2, 3, 4,5); 3) é assente una patologia extracardiaca potenzialmente emboligena.
Anche se teoricamente dovrebbero essere soddisfatti i tre criteri, nella realtà questo non accade per la coesistenza di patologie, cardiache e non, potenzialmente emboli gene, come ad esempio la fibrillazione atriale (FA) e le placche carotidee.
L’ipotesi di una genesi tromboembolica di un evento ischemico cerebrale si basa sia
su criteri neurologici, clinici e strumentali, che possano indirizzare verso una possibile
genesi cardioembolica sia su criteri cardiologici.
I criteri neurologici clinici di fonte emboligena prossimale sono rappresentati da: 1) pazienti con stroke corticale o cerebellare; 2) pazienti senza i fattori classici per ateroma o patologia dei piccoli vasi (fumo, ipertensione, diabete) quindi tutti gli stroke giovanili; 3) pazienti con interessamento contemporaneo di più territori e/o con normalità delle arterie; 4) comparsa di stroke durante una manovra di Valsalva (ad esempio tosse) compatibile con embolismo paradosso (rara). L’identificazione del territorio vascolare coinvolto con interessamento dei piccoli o dei grandi vasi cerebrali (con TAC o RMN) è fondamentale ai fini diagnostici e terapeutici: nei casi di stroke lacunare (occlusione di un‘arteria perforante, sclero-ialinosi delle piccole arterie lenticolo- striate per aterosclerosi, emparesi motoria pura, emiparesi atassica) l’ipotesi cardio-embolica è improbabile; nei casi di stroke parziale anteriore l’ipotesi cardio-embolica é verosimile; nei casi di stroke totale anteriore l’ipotesi cardio-embolica è verosimile; nei casi di stroke posteriore l’ipotesi cardio-embolica é poco verosimile. Tuttavia allo stato attuale non esistono specifici sottotipi di evento neurologico che possano escludere con certezza la possibilità di una origine cardioembolica.
 Tab.
1
Tab.
1
_______________________________________________________________________________________
 Tab. 2
Tab. 2
___________________________________________________________________________
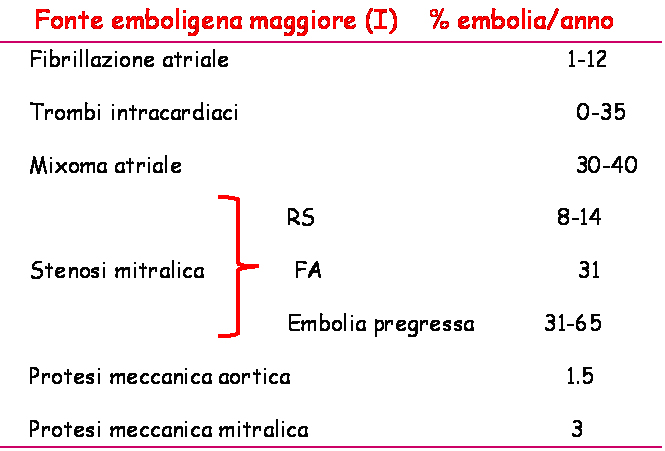 Tab. 3
Tab. 3
_________________________________________________________________
 Tab. 4
Tab. 4
____________________________________________________________________
 Tab. 5
Tab. 5
_______________________________________________________________
I criteri cardiologici di una genesi cardioembolica di un evento ischemico cerebrale sono rappresentati dall’anamnesi ( ad esempio recente infarto miocardico, fibrillazione atriale, scompenso cardiaco, valvulopatia emboligena, protesi intracardiache) e da indagini strumentali (ECG, ECG Holter, Eco transtoracico (ETT), Eco trans esofageo (ETE). Vanno comunque escluse altre cause di ischemia cerebrale, che possono agire con meccanismo funzionale: la caduta della pressione di perfusione per fattori emodinamici centrali (deficit di pompa, aritmie), lo scompenso cardiaco acuto, le aritmie ipo-ipercinetiche, lo shock. Dal punto di vista degli esami strumentali, sicuramente, come dimostrato dallo SPREAD 2010, l’ ETT è indicata in caso di sospetto clinico-anamnestico di malattia cardiaca (raccomandazione 5.5 Grado D), mentre l‘ ETE è indicato nel TIA o nell'ictus, di sospetta origine cardioembolica, solo nei pazienti di età <45 anni e qualora non vi siano cause evidenti dell'evento ischemico, o evidenze strumentali di malattia dei vasi cerebrali, o fattori di rischio maggiori (raccomandazione 5.6 Grado D). L’ETE trova una diffusa applicazione nella pratica clinica in presenza di fibrillazione atriale (FA), di patologia del setto interatriale (forame ovale pervio o FOP, aneurisma del setto interatriale o ASIA), di ateromi/placche aortiche, di masse cardiache, di patologie varie: valvulopatie mitraliche, aortiche, protesi etc). L’Ecocontrasto spontaneo ( SEC) è un indice di stasi ematica ed è considerato un fattore di rischio per la formazione di trombi, si associa a un aumentato rischio cardioembolico, si correla inversamente alla funzione dell’auricola sinistra, non è influenzato dalla terapia anticoagulante/antiaggregante; può essere ridotto dalla presenza di una insufficienza mitralica più che moderata, ma quest’ultima non è del tutto protettiva sulla formazione di trombi.
I Trombi intraatriali ed auricolari sono una evenienza non rara in vari contesti clinici e fisiopatologici, che vanno dalla presenza di disturbi del ritmo (FA, flutter atriale, ritmi atriali caotici etc.) a patologie della valvola mitrale, a gravi disfunzioni ventricolari etc. L’ETT, se correttamente eseguito e con apparecchiatura idonea, può essere utile per individuare la presenza di trombi atriali; ma è l’ETE che premette un accurato studio morfologico della massa trombotica intraatriale e soprattutto intraauricolare (sede più frequenta di localizzazione), risultando importante nella classificazione dei trombi e quindi nella stratificazione del rischio embolico. Infatti i trombi mobili a palla comportano un rischio embolico pari al 79.6%, mentre i trombi stratificati parietali e a stampo hanno un rischio embolico notevolmente più basso e pari al 9.1%. Con l’ETE si possono individuare quindi i markers di un elevato rischio embolico che sono la trombosi dell’auricola sinistra, la trombosi a palla dell’AS, il SEC denso di III-IV grado, le velocità di svuotamento dei flussi in auricola <20cm/sec. Tuttavia va ricordato chele indicazioni dell’ACCP alla profilassi anticoagulante non sono però basate sui reperti ETE.
La FA è l’aritmia più frequente (0,4% della popolazione). L’incidenza aumenta con l’età (circa il 2-5% > 60 aa e circa 10% > 80 aa). La sequela più significativa della FA è rappresentata dalle complicanze tromboemboliche (che aumenta con l’età). La maggioranza delle complicanze tromboemboliche sono ritenute causate dal SEC di grado >3, a trombosi nell’auricola sinistra o a trombosi atriale sinistra. In presenza di FA va effettuato un ETT sia per lo studio delle cavità cardiache e degli apparati valvolari, sia, in particolare, per lo studio anatomo-funzionale dell’atrio sinistro, sede prediletta dei trombi. Lo studio funzionale si avvale delle flussimetria PW della valvola mitrale e del TDI, che permettono di valutare il contributo della meccanica atriale al riempimento ventricolare. Le informazioni ricavabili dall’ETE sono utilizzate non solo ai fini diagnostici ma anche per una migliore selezione e valutazione dei pazienti da sottoporre a cardioversione e per la ricerca di indicatori che quantificano il rischio cardioembolico in generale e il rischio legato alla cardioversione elettrica e anche, seppure in misura minore, alla conversione farmacologica. Va ricordato comunque che l’ETE è una indagine moderatamente invasiva, non sempre ben accettata e tollerata dai pazienti. Come è noto la dilatazione dell’AS è frequente nei pazienti con FA, essa è una delle cause della comparsa e della persistenza della FA, ma la dilatazione dell’AS può essere anche causata dalla FA; la dilatazione dell’AS può ridurre la probabilità di ripristino e/o di mantenimento a lungo di RS (dato controverso); il ripristino del RS può far regredire la dilatazione dell’atrio sinistro. I rari casi può essere opportuno eseguire un ETE tridimensionale (3DECO), perché più accurato nel definire l’anatomia dell’auricola, o si può effettuare una Ecocontrastografia con mezzi di contrasto transpolmonari, per ottenere una migliore definizione dei contorni dell’auricola.
Valutazione del rischio cardioembolico nella FA
Se isolata (20%) comporta una bassissima probabilità di cardioembolismo (0,5-1% pz/anno), sovrapponibile ai pazienti senza FA, non comporta indicazioni a terapia antitrombotica. Se FA non valvolare o FANV (70%), ma associata ad altre cardiopatie (ipertensiva, ischemica, congenita, cardiomiopatie,ecc.) il rischio cardioembolico è da valutare: secondo molti studi risulterebbe 5 volte superiore al rischio dei soggetti in RS, con una incidenza annua fino al 5% per paziente. Se FA valvolare (10%), associata a valvulopatia prevalentemente mitralica e reumatica il rischio cardioembolico è > 17%/anno; vi è indicazione assoluta al trattamento anticoagulante orale (TAO). Se la FA è di recente insorgenza, le dimensioni dell’AS non sono particolarmente elevate, la cardiopatia sottostante non è in fase avanzata e le probabilità di mantenimento del RS sono buone, è proponibile, previa valutazione clinica ed ecocardiografica e la protezione con terapia antitrombotica/anticoagulante, l’effettuazione di una cardioversione elettrica o farmacologica (CV), ricordando che in pazienti non scoagulati la CV della FA si associa a un rischio di stroke dello 0-5,6%. Studi osservazionali hanno rilevato una riduzione dello stroke in pz. trattati con warfarin. Sulla scorta di tali dati le linee guida attuali dell’ACCP raccomandano un trattamento con warfarin per 3 settimane prima e 4 settimane dopo la CV in tutti i pz. con FA che duri da oltre 48 ore. Il trattamento anticoagulante tradizionale per 3 settimane in caso di CV programmata nella FANV insorta da più di 48 ore, comporta la somministrazione di anticoagulanti anche in pz. che non hanno trombi, rischi emorragici maggiori correlati all’ età (1-2%) e rischi emorragici minori. Inoltre la corretta scoagulazione non è raggiunta nel 25-50% dei pazienti (ad ogni valore non corretto di scoagulazione si dovrebbe iniziare nuovamente il computo delle 3 settimane). Perciò spesso la TAO provoca ritardo nella esecuzione della procedura di CV. Occorre però considerare che la durata della FANV è inversamente correlata al successo del ripristino del RS, è inversamente correlata alla durata del ripristinato RS (direttamente correlata alle recidive), è direttamente correlata allo stordimento atriale ed auricolare sx (stunning) post cardioversione. Va ricordato che se la durata della FA è<1 settimana si ha il recupero della funzione atriale in meno di 24 h; se la durata è di 2-6 settimane il recupero avviene oltre una settimana; se la durata è >6 settimane il recupero può richiedere diverse settimane. Quindi vanno considerate le problematiche delle diverse scelte terapeutiche: una durata della TAO eventualmente prolungata di 7-8 settimane comporta un aumentato rischio emorragico; una prolungata durata della FA può comportare una riduzione del successo della CV. L’ETE è stato inizialmente proposto in alternativa alla TAO, poiché teoricamente si può effettuare una CVE se l’ETE è negativo per trombosi atriale o per SEC di alto grado etc. Ma l’ETE da solo non è sufficiente per escludere-minimizzare il rischio trombo embolico. Sono state infatti segnalate embolie post-CV in pz. non adeguatamente scoagulati che avevano un ETE pre-CV negativo per trombosi atriale o anche in pazienti correttamente trattati con TAO e nel range terapeutico dell’INR a causa di una possibile trombosi atriale de novo secondaria a stunning post-Cv dell’AS/AuS. La maggioranza degli eventi che si verificano nella prima settimana successiva alla CV sono causati dallo stunning atriale. Va ricordato che lo stunning dell’ AuS è indipendente dalla modalità di CV e può verificarsi con CV elettrica farmacologica o anche spontanea; lo stunning dell’ AuS è meno evidente con FA di breve durata; lo stunning dell’AuS può essere presente anche dopo CV di Flutter Atriale; può esserci dissociazione tra stunning dell’AS e stunning dell’AuS. Nella FA insorta da più di 48 ore la cardioversione eseguita senza adeguata TAO è complicata da un evento tromboembolico immediato o tardivo nel 3.4-7.1% dei pazienti con aumento del rischio di circa 5 volte nella prima settimana: l’uso di TAO per tre settimane prima e 4 settimane dopo la cardioversione riduce l’incidenza del cardioembolismo a circa l’1.2% (
Il Flutter atriale (FLA) è un’aritmia relativamente organizzata, ritenuta in passato a basso o assente rischio tromboembolico. L’utilizzo di profilassi anticoagulante nei pz. con FLA (sia in assoluto che in associazione a CVE) è stato in passato controverso. La Società Italiana di Ecografia Cardiovascolare (SIEC) ha patrocinato uno studio multicentrico osservazionale: l’ ETE nei pazienti con FLA isolato (studio FLASIEC: Flutter Atriale Società Italiana di Ecografia Cardiovascolare). L’American College of Chest Physicians raccomanda per i pazienti con FLA lo stesso iter diagnostic-terapeutico dei pazienti con FA e identifica gli stessi parametri valutativi di rischio cardioembolico.
Singer
Il FOP viene spesso ricercato come causa di cardioembolismo. Va tuttavia ricordato che si tratterebbe di embolia paradossa e che questo evenienza è rara, eccetto che nei casi di embolia polmonare acuta, con aumento significativo della pressione in atrio dx (PAD), scollamento del septum primum dal secundum, apertura del tunnel e passaggio di tromo-emboli dall’AD all’AS e da qui in VS e in aorta. In assenza di ↑PAD non è ipotizzabile una del causalità FOP, eccetto che in casi di età giovane, di associazione ASIA + PFO, di evidente ampio shunt atrio dx → atrio sin. L’ETE è ritenuto l’esame gold standard per la valutazione del FOP, ma anche l’ETT, se di buona qualità. Va eseguito ETE o ETT con la manovra di Valsalva o facendo effettuare vigorosi colpi tosse al paziente, durante somministrazione di soluzione salina agitata o di mezzi di contrasto trans-polmonare, e valutando il numero di bolle e il loro tempo di comparsa in AD. Nella genesi del cardioembolismo secondaria a FOP, sono stati ipotizzati diversi meccanismi: l’origine da trombosi delle vene profonde (dimostrate nel 5-10% dei casi); la trombosi dell’ASIA o nel “tunnel”, l’aumentata incidenza di aritmie atriali, lo stato di ipercoagulabilità.
L’aneurisma del setto interatriale (ASIA) può essere definito come una dilatazione aneurismatica del SIA o di parte di esso. Vari Autori hanno proposto vari criteri diagnostici: 1) protrusione>13mm, escursioni fasiche durante il respiro >13mm, base >13mm diametro (Marazanof); 2) ampiezza base tra 13 e 15mm , in genere>20mm (Langohlz); 3) protrusione ed oscillazione sul piano del SIA >5mm e base d’impianto >15mm (Hanley); 4) escursione>11mm, base d’impianto>15mm (Pearson); 5) membrana fossa ovale ampia (area 71mm2), membrana sottile (6mm), rapporto membrana fossa ovale/area fossa ovale >1.5 ( Shirani, studio autoptico).L’ASIA viene classificato in vari modi; la classificazione più adottata è quella che identifica 5 tipi: 1R SIA sporgente solo a dx; 2L SIA sporgente solo a sin; 3RL SIA ha escursione a dx > che a sin; 4LR SIA ha escursione a sin>che a dx; 5 SIA con movimento è bidirezionale ed equidistante. L’ASIA può essere primitivo:1) in associazione a MVP (deficit tessuto connettivo); 2) con shunt per associazione con FOP o DIA; 3) con possibile embolizzazione da trombo formatosi sulla superficie atriale della mitrale o nell’angolo tra endocardio atriale e superficie atriale di LPM prolassante; o secondario (eccessiva differenza pressoria tra gli atri e nell’ambito di cardiopatie congenite complesse). L’incidenza dell’ASIA varia dal 1.2% (Katayama) al 5% (Bordeaux), come forma isolata, al 61% dei casi in associazione a FOP (Marazanof), al 14% dei casi in associazione a DIA (Marazanof). L’incidenza di eventi cerebro-vascolari in pazienti con ASIA va dal 20 al 52% . Tra i pazienti con stroke il 15% ha ASIA, tra i pazienti senza stroke il 4% ha ASIA. Il 44.6% dei pazienti con ASIA ha avuto tromboembolia prima dell’ECO. La causa dell’embolismo è da ricondurre o alla presenza di un trombo in situ o di un trombo migrante con embolia paradossa attraverso l’ASIA o a tachiaritmie con trombosi atriale secondaria o all’effetto sinergico tra ASIA e FOP. Tuttavia non tutti gli autori sono concordi nel riscontrare una correlazione tra ASIA e trombo embolia; sono contrari, sulla base di esperienze personali e di studi, alcuni autori come Roijer, Kucherer, Burger, Fagan, Natanzon et al.; sono favorevoli altri come Marazanof, Mugge, Lorenzoni et al. ; rilevano una correlazione probabilmente positiva, se associato a FOP, Katayama, Pearson, Hanna, Shirani, Terasaki, Ilercil, Rusznak, Mastroroberto e altri. In conclusione: 1) non è chiaro se l’ASIA è di per se un fattore di rischio tromboembolico o se ciò dipende dall’associazione con altre anomalie; le casistiche sono falsate dalla selezione dei pazienti; 2) l’ASIA isolato dovrebbe essere considerato “benigno”, soprattutto se limitato alla fossa ovale, con escursioni limitate e respiratorie, e destrorso; in tali casi non è necessaria alcuna terapia. Probabilmente è da considerare “non benigno” l’ASIA che coinvolge tutto il SIA, con aspetti circonvoluti o con marcate escursioni non fasiche, nei pazienti con patologia tromboembolica (stroke etc.). In tali casi sarebbe necessaria terapia con antiaggreganti o TAO (prevenzione secondaria), anche se non vi sono studi che confermano il valore protettivo di tale strategia; 3) frequentemente l’ASIA è associato ad altre anomalie potenzialmente trombo-emboliche (FOP, DIA, MVP, FA etc.). Questa associazione è quasi sicuramente di significato “non benigno” e, nei pazienti con pregresso tromboembolismo (stroke etc.), merita adeguato trattamento medico o interventistico (prevenzione secondaria e terziaria).
Tromboembolia polmonare
Le manifestazioni cliniche dipendono dalla grandezza del trombo e dove esso si va a localizzare nel’arteria polmonare. Emboli di grandi dimensioni possono occludere completamente l’arteria polmonare o i suoi rami principali. I polmoni non vanno incontro ad infarto perché ricevono sangue da circoli collaterali che connettono le arterie bronchiali, che originano dall’aorta, con le arterie polmonari. La cianosi e la dispnea sono le conseguenze dirette della inadeguata ossigenazione del sangue. Le sezioni cardiache di destra si dilatano, così come le arterie polmonari, la pressione nell’arteria polmonare aumenta, il ventricolo sinistro diventa insufficiente ad irrorare adeguatamente il cervello ed altri organi vitali, la PA può scendere a valori molto bassi e il paziente andare incontro a shock. Emboli più piccoli possono oltrepassare i rami principali dell’arteria polmonare, andando ad occludere i rami più piccoli che irrorano i lobi inferiori dei polmoni. La pressione polmonare aumenta, i circoli collaterali diventano inadeguati e i segmenti polmonari interessati possono andare incontro a necrosi infartuale. Si manifesta dispnea, doloro toracico di tipo pleurico, tosse, espettorato ematico. I trombi possono essere di origine cardiaca, cioè essere nati in atrio destro o, più raramente, in ventricolo destro, o essere “trombi in transito”, cioè essere nati nei distretti venosi della parte inferiore del corpo, e attraversare momentaneamente il cuore per arrestarsi definitivamente nel circolo polmonare. Talvolta i trombi, nel loro arrivo in atrio destro, possono impegnarsi nel forame ovale pervio e quindi transitare nelle sezioni cardiache di sinistra per diffondersi nel circolo sistemico e talvolta anche nel cervello. Questa ipotesi va quindi indagata nei casi di tromboembolismo cerebrale, quando sono state escluse la cause di pertinenza delle sezioni cardiache di sinistra e dell’aorta o dei suoi rami. L’anamnesi di situazioni patologiche potenzialmente emboligene o di pregressi episodi tromboembolici polmonari, l’ETT ed eventualmente l’ETE, con la manovra di Valsalva e la somministrazione di soluzione salina o di agenti contrastografici, e il Doppler transcranico possono essere di grande ausilio nella identificazione di questa sindrome a volte fatale, a volte causa di ipertensione polmonare cronica/ingravescente, a volte reversibile e senza significativi esiti.
Endocardite
L’endocardite può essere causa di embolia sia polmonare che sistemica. Tra le cause di tromboembolia polmonare vanno ricordate le endocarditi su valvole native, su protesi, su cateteri intracavitari, su elettrocateteri, conseguenti ad agenti batterici o fungini; tra la cause di tromboembolismo sistemico vanno ricordate le endocarditi su valvole native e su protesi valvolari. Oltre ai criteri anamnestico-clinici, vi sono criteri ecocardiografici che prevedono non solo l’esecuzione di esami seriati (ETT e ETE), ma anche l’identificazione di specifiche caratteristiche ecografiche diagnostiche e/o predittive di rischio emboligeno. Questo è correlato alle dimensioni e alla mobilità: aumentato se vegetazioni grandi (>10 mm), particolarmente elevato se mobili e grandi (>15 mm), con il massimo rischio nei primi giorni dopo inizio della terapia antibiotica e la sua diminuzione dopo 2 settimane di terapia.
Tumori intracardiaci
I tumori cardiaci, primitivi o secondari, benigni o maligni, possono essere responsabili di tromboembolismo, anche cerebrale. Ne sono soprattutto responsabili alcuni tumori, specie quelli peduncolati, mobili , a margini irregolari e frastagliati, che facilmente possono andare incontro a frammentazione e, quindi, a embolizzazione. Questi tumori possono essere adesi alle pareti cardiache (setto interatriale, pareti atriali, sbocchi venosi, pareti ventricolari ) o agli apparati valvolari, sono facilmente diagnosticabili con ETT, ETE e raramente richiedono l’esecuzione di altre indagini diagnostiche (TC o RMN cardiaca). La loro identificazione ed il loro trattamento, quasi esclusivamente chirurgico, rappresenta il modo per minimizzare il rischio del tromboembolismo.
BIBLIOGRAFIA ESSENZIALE
Arnold AZ, Mick MJ, Mazurek RP, et al. Role of prophylactic anticoagulation for direct current cardioversion in patients with atrial fibrillation or atrial flutter. J Am Coll Cardiol. 1992 Mar 15;19(4):851-5.
Arnow WS et al. Echocardiographic findings associated with atrial fibrillation in 1,699 patients aged > 60 years. Am J Cardiol 1995;76:1191.
Cereda M, Trocino G. Echocardiography in patients with acute cerebrovascular syndromes. Rational use and clinical impact. Ital Heart J Suppl. 2002 Jan;3(1):26-35.
Dittrich HC et al. Echocardiographic and clinical predictors for outcome of elective cardioversion of atrial fibrillation. Am J Cardiol 1989;63:193.
Guidelines for the management of atrial fibrillation The Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC) European Heart Journal (2010) 31, 2369–2429
Jin KN, Chun EJ, Choi SI, et. al. Cardioembolic origin in patients with embolic stroke: Spectrum of imaging findings on cardiac MDCT. AJR Am J Roentgenol. 2010 Jul;195(1):W38-44.
Kamp O, Verhorst PMJ, Welling RC, Visser CA. Importance of left atrial appendage flow as a predictor of thromboembolic events in patients with
atrial fibrillation European Heart Journal (1999) 20, 979–85
Leung DY et al. Prognostic implications of left atrial spontaneous echo contrast in nonvalvular atrial fibrillation. J Am Coll Cardiol 1994;24:755.
Pepi M, Evangelista A, Nihoyannopoulos P, et. al. European Association of Echocardiography. Recommendations for echocardiography use in the diagnosis and management of cardiac sources of embolism: European Association of Echocardiography (EAE) (a registered branch of the ESC). Eur J Echocardiogr. 2010 Jul;11(6):461-76.
Sanfilippo AJ et al. Atrial enlargement as a consequence of atrial fibrillation. A prospective echocardiographic study. Circulation 1990;13:617.
Van Gelder IC et al. Decrease of right and left atrial sizes after direct current electrical cardioversion in chronic atrial fibrillation. Am J Cardiol 1991;67:93.
Zabalgoitia M. et al. Transesophageal echocardiographic correlates of clinical risk of thromboembolism in nonvalvular atrial fibrillation. J Am Coll Cardiol 1998;31:1622.
Giovanni Minardi, Patrizia Mattacola
Cardiodiagnostica non invasiva A.O. San Camillo-Forlanini
Università “La Sapienza” Roma