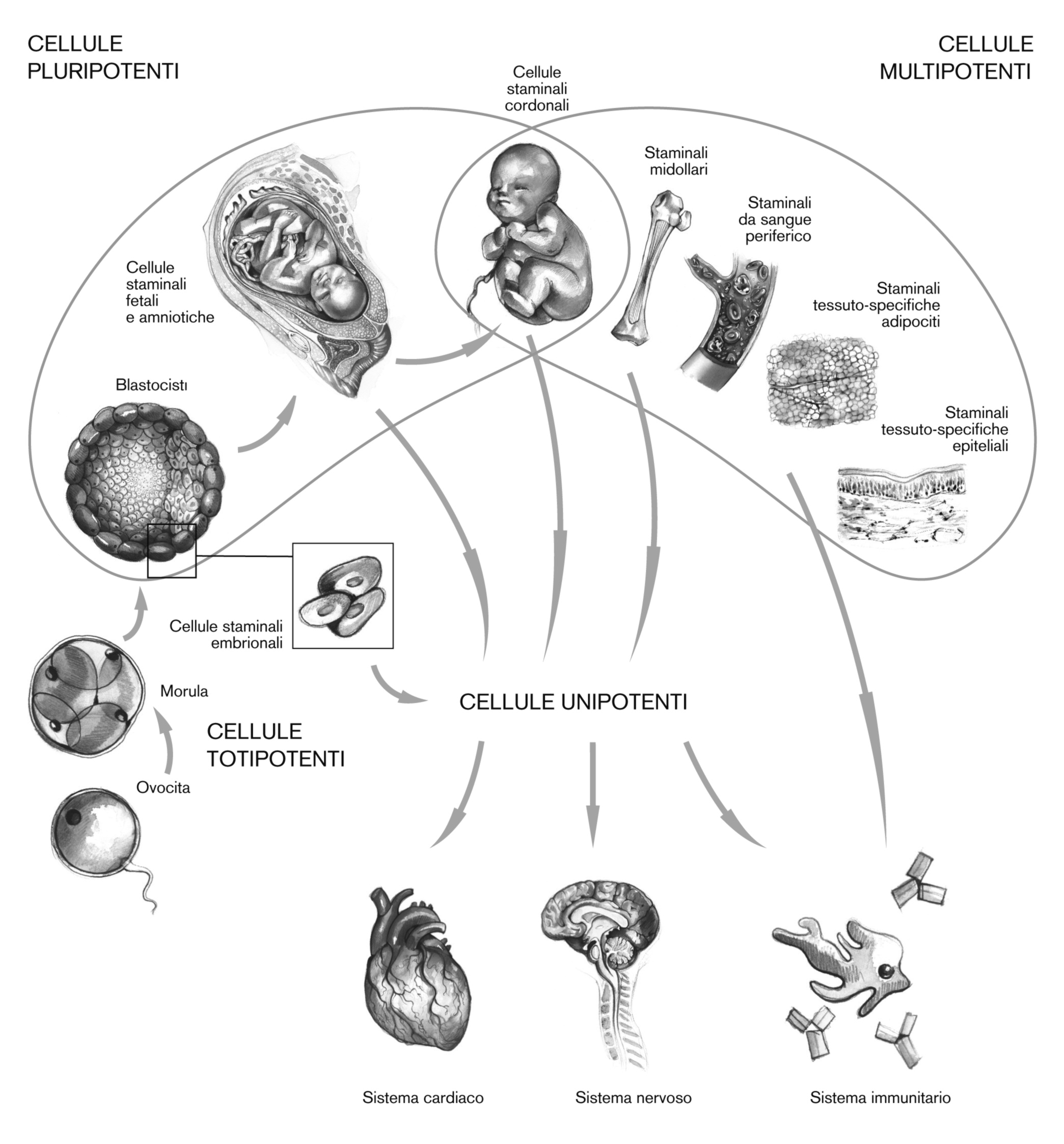
 Fig. 1 - Fonti di
cellule staminali e loro rispettive potenzialità
Fig. 1 - Fonti di
cellule staminali e loro rispettive potenzialitàACCADEMIA LANCISIANA
ASPETTI ATTUALI DELL’ACCOMPAGNAMENTO ALLA NASCITA
Martedì 11 Gennaio, 2011
ANALISI COMPARATIVA TRA CELLULE STAMINALI PLURIPOTENTI E MULTIPOTENTI
Relatore: Dott. Irene Martini - Via Lorenzo Magalotti, 2 - 00197 Roma. Tel. 348
019 76 74
email: irene.martini@uniroma1.it; martini@smartbankfoundation.org
ATTI CONGRESSUALI
Le cellule staminali
Le cellule staminali sono definite come una popolazione di cellule
indifferenziate dotate della capacità
sia di autorigenerarsi sia di produrre una progenie di cellule in grado di
specializzarsi.
L’embriologia racchiude il susseguirsi di passaggi che svelano l’identità
cellulare come motore della
biologia dello sviluppo. Le cellule germinali si incontrano e avviene la
fusione. Tale momento determina la
formazione di cellule staminali totipotenti che a distanza di pochi giorni
perderanno tale potenzialità per
dar vita alle cellule staminali pluripotenti presenti nella massa interna della
bastocisti giovane e poi, con
la formazione dell’ipoblasto e dell’epiblasto, alle diverse linee di cellule
multipotenti (1).
L’ultimo decennio ha visto un’esplosione di interesse per le cellule staminali
in generale e in particolare
per le cellule staminali embrionali (SE) umane. L’attenzione ha acceso speranze
e paure in tante persone,
dai familiari dei malati ai politici, a chi si occupa di problemi etici.
Isolate da James Thomson nel 1998, le cellule staminali embrionali sono oggetto
di forti controversie
legislative in molti paesi (2). Alcuni Paesi autorizzano la ricerca sperimentali
e i trias clinici altri li bandiscono
per motivi etici.
Di fatto le SE benché essere una fonte di inestimabile valore non trovano
applicazioni cliniche su larga
scala a causa della loro capacità di indurre una forma di tumore, il teratoma,
oltre alla mancanza di controllo
totale sul differenziamento indotto e ai noti problemi etici inerenti alla loro
estrazione in una fase estremamente
precoce della vita. L’unica applicazione terapeutica oggi disponibile a partire
da SE è il trapianto di oligodendrociti
predifferenziati in vitro a partire da SE per la cura delle lesioni al midollo
spinale (studio clinico autorizzato
dall’FDA a carica della Geron, US; link http://www.clinicaltrials.gov/ct2/results?term=spinal+cord+injury+AND+geron
Nel loro percorso di specializzazione le cellule staminali passano dalla fase di
“Totipotenza”, quando
possono dare vita ad ogni tipologia di cellula comprese quelle degli annessi
embrionali, alla fase di “Pluripotenza”,
capaci di svilupparsi solo in cellule che formano un individuo e capaci di
produrre la linea germinale,
e poi a quella di “Multipotenza”, come le cellule cordonali, midollari, da
sangue periferico, adipose
SmartBank Foundation
30 City Road - London EC1Y 2AB – United Kingdom
Company Number 6884389
www.smartbankfoundation.org
e tessuto-specifiche che danno origine a 3 importanti foglietti germinali (ecto-,
meso-, endo- derma); fino
a divenire cellule staminali unipotenti, finalizzate cioè a generare solo un
tipo di cellule con una funzionalità
specifica.
Da molto tempo è noto il trapianto di cellule staminali ematopoietiche estratte
da midollo osseo e da
sangue periferico a seguito di emaferesi (tecnica di arricchimento della
concentrazione di cellule staminali
a seguito di stimolazione con fattori di crescita).
Nell’ultimo ventennio, si è poi affermato l’uso terapeutico di cellule staminali
ematopoietiche derivanti
dalla vena cordonale. Le cellule staminali ematopoietiche (CSE) sono “l’origine”
delle cellule che costituiscono
il nostro sangue e il sistema immunitario. Negli adulti, la sede di queste
cellule progenitrici è il midollo
osseo, un complesso tessuto molle che occupa gli spazi cavi delle ossa, specie
di quelle grandi e
piatte. Durante la vita, un gran numero di CSE si differenzia in continuazione
per rifornire sangue e organi
linfoidi di cellule mature e per sostituire le cellule che completano il loro
ciclo vitale o sono eliminate o
perse. Le CSE sono dunque essenziali per lo sviluppo e la sopravvivenza. La
capacità delle CSE di ripopolare
sangue e sistema immunitario è importante per il trattamento di alcuni disturbi.
Infatti, la somministrazione
di CSE può “aiutare” il paziente con malfunzionamento del midollo osseo legato a
una terapia
radiologica o a una chemioterapia, generando una progenie di nuove cellule sane.
Nel 2009, per la prima volta, il numero di campioni bancati di cellule cordonali
ha superato il numero
di campioni disponibili a partire da midollo osseo (3).
I vantaggi delle cellule staminali cordonali risiedono nell’elevato numero di
CSE, nella possibilità di effettuare
una chemioterapia più blanda, nel ridotto evento Graft Versus Host Disease (GVHD),
nell’elevata
immunopotenzialità dei linfociti Treg, in una maggiore reattività Graft Versus
Leukemia (GVL), nella possibilità
per etnie minori o miste di accedere ad una fonte di staminali meno aggressiva
nei confronti del proprio
sistema immunitario.
Le cellule staminali cordonali mostrano però maggiore lentezza di produzione di
neutrofili e piastrine.
Una caratteristica specifica del cordone riguarda la presenza di telomeri lunghi
sui cromosomi delle
cellule staminali cordonali che conferisce loro una capacità proliferativa anche
in vitro e per questo motivo
le cellule prelevate alla nascita vengono comunemente chiamate cellule neonatali
a differenza di quelle
adulte.
Oltre alle cellule staminali di origine ematopoietica esistono cellule stromali
mesenchimali e progenitori
endoteliali presenti nel midollo osseo così come nel sangue cordonale che è
maggiormente ricco rispetto
al primo di progenitori cellulari (eritroidi, megacariocitici e dei globuli
bianchi).
Le cellule stromali mesenchimali (CSM) danno origine al tessuto osseo,
cartilagineo, tendineo, muscolare
scheletrico e adiposo e possono essere estratte da midollo osseo, sangue venoso
cordonale, tessuto
adiposo o polpa dentale. L’origine delle CSM sembra derivare dai periciti (Il
pericita è un tipo di cellula
connettivale che circonda parzialmente le cellule endoteliali dei capillari e
delle venule).
Le CSM hanno degli effetti paracrini estremamente importanti grazie al loro
tropismo in direzione del
SmartBank Foundation
30 City Road - London EC1Y 2AB – United Kingdom
Company Number 6884389
www.smartbankfoundation.org
danno tissutale e alla loro capacità di rilasciare fattori di crescita che
svolgono un effetto benefico sul tessuto
da riparare come avviene già per l’infarto acuto del miocardio. D’altra parte è
noto in applicazione
terapeutica l’effetto immunomodulatorio che oggi vede queste cellule in
trapianti combinati con cellule
staminali ematopoietiche e in prove cliniche relative a patologie autoimmuni.(4)
Le applicazioni terapeutiche odierne e future
Oggi le patologie trattabili con le cellule multipotenti sono più di 80 e sono
classificate in base all’uso
“autologo” e/o “allogenico” (o “eterologo”) del trapianto. Ad esempio: alcune
forme di leucemia o malattie
genetiche come la talassemia necessitano di cellule provenienti da un’altra
persona e non dal paziente;
in tali casi s’interviene con un trapianto allogenico (studi di terapia genica,
però, stanno mettendo a punto
tecniche di sostituzione del gene difettivo con un gene funzionante nelle
staminali del paziente, preventivamente
prelevate e, pertanto, si ritiene che anche in applicazioni di natura
monogenetica sarà possibile
l’autotrapianto).
E’ dovere ricordare che l’uso eterologo è raro a causa della scarsa
istocompatibilità tra soggetti non
appartenenti allo stesso nucleo familiare. Infatti i dati pubblicati
recentemente dalla dott. Gluckman sulla
rivista Haematologica dimostrano che, oltre alla elevata istocompatibilità tra
consanguinei, i trapianti familiari
hanno il 63% di aspettative di sopravvivenza contro il 23% tra non consanguinei
(5).
Per molte altre patologie come alcuni linfomi, disturbi mieloproliferativi,
mielodisplastici, delle plasmacellule,
del midollo osseo, alcuni tipi di tumori, l’istiocitosi e molte ancora si
prevede un uso per trapianto
sia autologo che eterologo.
Secondo i dati dei centri trapianti internazionali, le patologie che trovano
maggior supporto terapeutico
dalle cellule staminali sono la Leucemia Linfoide Acuta, la Leucemia Mieloide
Acuta e Cronica, le Immunodeficienze
e la Talassemia Beta.
Le nuove frontiere della biologia oggi pongono quesiti più complessi nel
trattamento di patologie cardiologiche,
diabetologiche e neurologiche. Diversi studi clinici sono infatti in corso per
la validazione di queste applicazioni
terapeutiche, in particolare per il diabete di tipo I insulino-dipendente,
l’infarto acuto del miocardio, le
patologie autoimmuni, l’ictus, la paralisi cerebrale infantile e le lesioni al
midollo spinale (www.clinicaltrials.gov).
La rivoluzione delle cellule pluripotenti indotte (induced Pluripotent Stem
Cells, iPS)
Sono passati tre anni da quando Shinya Yamanaka ha pubblicato un lavoro
rivoluzionario su Cell (6). Il
ricercatore giapponese è riuscito a portare indietro l’orologio biologico delle
cellule e a fare in modo che
queste riacquisiscano le caratteristiche delle cellule staminali pluripotenti.
L’ingegneria molecolare alla base di tale retroinduzione risiede
nell’inserimento di fattori trascrizionali
per mezzo di un retrovirus o di un lentivirus o piuttosto di small molecules in
grado di riaprire la disponibilità
di geni altrimenti silenti in una cellula programmata a svolgere una funzione
specifica (7). Oltre all’incom-
SmartBank Foundation
30 City Road - London EC1Y 2AB – United Kingdom
Company Number 6884389
www.smartbankfoundation.org
SmartBank Foundation
30 City Road - London EC1Y 2AB – United Kingdom
Company Number 6884389
www.smartbankfoundation.org
mensurabile vantaggio etico che non prevede più l’uso di cellule embrionali
derivanti da blastocisti, vi è la potenzialità di studiare patologie
cardiologiche, diabetologiche, nefrologiche e neurologiche e di trovare
per esse rimedi terapeutici di fondamentale importanza. In particolare
per ciò che riguarda studi di modello patologico e di screening farmacologico
(8).
L’elemento che contraddistingue le SE dalle iPS riguarda la memoria
epigenetica ovvero le cellule retroindotte sono il testimone della vita di
contaminazioni e mutazioni indotte dall’ambiente che non erano presenti
alla nascita e che potrebbero essere concausa di molte patologie
umane. Le iPS, analogamente alle SE hanno la capacità di produrre
forme tumorali e di dar vita alla linea germinale.
La fonte da cui si otterranno le cellule iPS (Induced Pluripotent Stem
Cells) sono le cellule differenziate del paziente per lo studio delle patologie
e le cellule staminali cordonali come fonte più efficiente e speculare
alla genetica del bambino al momento della nascita (Banca di
Kyoto).
La firma epigenetica ha un valore incommensurabile nella valutazione
di un quadro patologico. Tale firma non si esprime solo con l’accumulo
di mutazioni e di inserzioni geniche ma anche come fattore
discriminante tra le varie fonti di cellule staminali. Gli elementi di maggior
interesse scientifico sono i microRNA, la mutazione e lo stato di
attivazione di trascrizione immediata che alcune cellule staminali conservano
(9).
In conclusione, benché l’interesse sperimentale relativo alla conoscenza
della macchina biologica e degli elementi che la regolano risieda
nelle cellule embrionali, le applicazioni cliniche oggi disponibili sono
prevalentemente a carico delle cellule somatiche multipotenti e la vera
scommessa di far coincidere l’elevata potenzialità cellulare con una più
ampia gamma di patologie umane trattabili è ad oggi celata nella disponibilità
terapeutica delle cellule retroindotte.
Bibliografia
1) J, Silva, , J. Nichols, T. W. Theunissen,,
G. Guo, A. L. van Oosten,
O. Barrandon, J. Wray, S. Yamanaka,
I. Chambers, and A. Smith;
Nanog Is the Gateway to the Pluripotent
Ground State Nanog Is the
Gateway to the Pluripotent Ground
State; Cell 138 (2009) Aug.:722-
737
2) J.A. Thomson, J. Itskovitz-Eldor,
S.S. Shapiro, M.A. Waknitz, J.J.
Swiergiel, V.S. Marshall, J.M.
Jones, Embryonic Stem cells lines
derived from Human Blastocyst,
Science. (1998) Nov
6;282(5391):1145-7
3) H.E. Broxmeyer, Cord blood hematopoietic
stem cell transplantation
In: StemBook [Internet]. Cambridge
(MA): Harvard Stem Cell Institute;
2008-. 2010 May 26.
4) A.J. Nauta and W.E. Fibbe, Immunomodulatory
properties of mesenchymal
stromal cells. Blood,
(2007) 15 Nov, volume 110, number
10.
5) E. Gluckman, V. Rocha, Cord
blood transplantation: state of the
art, Haematologica 94 (2009) 451–
454.
6) K.Takahashi , K.Tanabe , M. Ohnuki
, M. Narita , T. Ichisaka , K.
Tomoda , S. Yamanaka , Induction
of pluripotent stem cells from adult
human fibroblasts by defined factors
Cell, (2007) Nov
30;131(5):861-72.
7) S. Yamanaka, H.M. Blau, Nuclear
reprogramming to a pluripotent
state by three approaches Nature.
(2010) Jun 10;465(7299):704-12
8) S, Yamanaka. Patient-specific pluripotent
stem cells become even
more accessible Cell Stem Cell.
(2010) Jul 2;7(1):1-2
9) P. Aranda., X. Agirre., E. Ballestar,
E. J. Andreu, Jose R. Gómez, I.
Prieto, J. II. Martın-Subero, J. Cruz
Cigudosa, R. Siebert, M. Esteller, F.
Prosper, Epigenetic Signatures
Associated with Different Levels of
Differentiation Potential in Human
Stem Cells. PLoS, (2009), 11
SmartBank Foundation
30 City Road - London EC1Y 2AB – United Kingdom
Company Number 6884389
www.smartbankfoundation.org
Fig.1 Fonti di cellule staminali e loro rispettive potenzialità
SmartBank Foundation - 30 City Road - London EC1Y 2AB – United Kingdom - Company
Number 6884389 -
www.smartbankfoundation.org
Fig.2 Sviluppo embrionale e ontogenesi delle cellule staminali
multipotenti
Fig.3 Tratto da Nature (Vol 465) S. Yamanaka and H.M Blau (7).
Generazione di cellule iPS a partire da fibroblasti trasdotti con un retrovirus
codificante per i quattro fattori di pluripotenzialità
 Fig. 1 - Fonti di
cellule staminali e loro rispettive potenzialità
Fig. 1 - Fonti di
cellule staminali e loro rispettive potenzialità
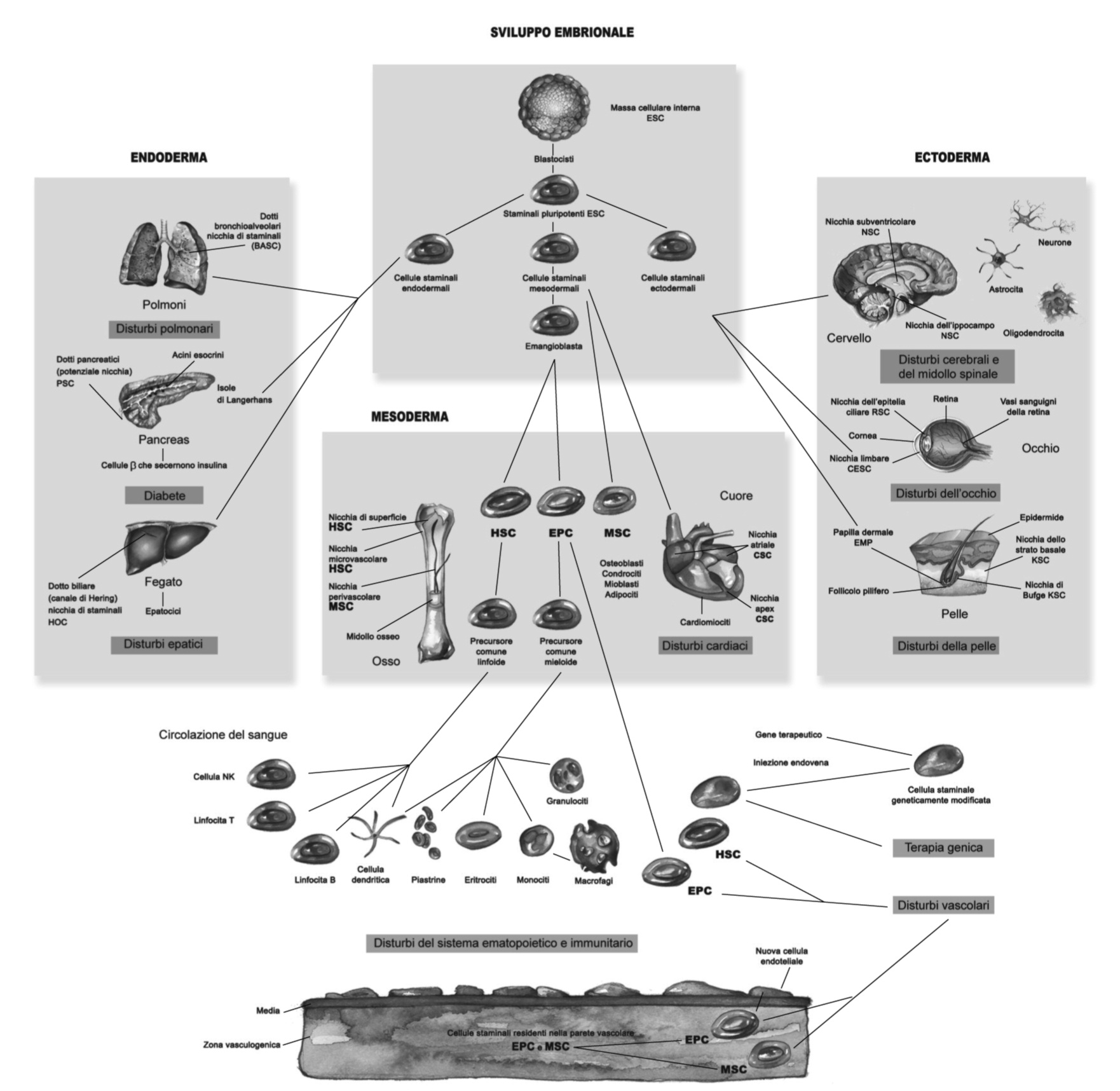
Fig.2 Sviluppo embrionale e ontogenesi delle cellule staminali multipotenti

Fig.3 Tratto da Nature (Vol 465) S. Yamanaka and H.M Blau (7). Generazione di
cellule iPS a partire da fibroblasti trasdotti con un retrovirus
codificante per i quattro fattori di pluripotenzialità