LE
SINDROMI MIELOPROLIFERATIVE CRONICHE
R.
Latagliata
Le Sindromi
Mieloproliferative Croniche - o Neoplasie Mieloproliferative Croniche (NMC)
secondo la nuova classificazione WHO – sono un gruppo di malattie identificato
negli anni’50 da Dameschek che comprende la Leucemia Mieloide Cronica (LMC), la
Mielofibrosi Idiopatica (MI), la Policitemia Vera (PV) e la Trombocitemia
Essenziale (TE). Le caratteristiche comuni di queste patologie sono
essenzialmente quattro:
·
L’aumentata proliferazione
delle linee maturative
midollari mieloidi, con un conseguente eccesso di produzione ed incremento
numerico a livello periferico di globuli bianchi, globuli rossi e piastrine
variamente presente nelle diverse NMC
·
La
normale differenziazione
di tali elementi, che si presentano morfologicamente indistinguibili dalle
cellule normali e spesso conservano una normale funzionalità
·
L’andamento cronico
con una fase di latenza
spesso misconosciuta ed una sopravvivenza anche in assenza di cure specifiche
che si misura nell’ordine di anni
·
La
tendenza (anch’essa
variabile nelle diverse NMC) ad evolvere in una fase terminale di leucemia
acuta, definita crisi blastica (CB)
Il meccanismo
ezio-patogenetico comune è l’attivazione costitutiva di una tirosin-chinasi (TK)
da mutazione puntiforme (JAK-2), traslocazione cromosomica (bcr/abl) o mutazione
di un attivatore (CALR) nella cellula staminale totipotente: in questo senso, le
NMC possono essere considerate delle “tirosin-chinasipatie”. Le TK sono molecole
proteiche dotate della caratteristica comune di fosforilare i residui di
tirosina delle proteine-bersaglio attivandole: per essere attive in condizioni
normali, le TK devono dimerizzare
e possono essere situate sulla
membrana (funzione recettoriale del segnale) o nel citoplasma (funzione di
trasduzione del segnale).
Attivano sempre un grande
numero di substrati e vie di trasmissione a valle (amplificazione del segnale)
In condizioni normali sono
costitutivamente
inattive e, una volta attivate, possiedono siti di regolazione che ne
interrompono l’attività
MIELOFIBROSI IDIOPATICA
La MI è una NMC Ph
neg caratterizzata da fibrosi midollare, splenomegalia (dovuta alla emopoiesi
extramidollare) ed anemia. E’ tra le NMC Ph neg. quella dal quadro clinico più
rilevante ed anche quella a prognosi più sfavorevole. Si tratta di una patologia
rara dell’età adulta, la cui incidenza è compresa tra 0,5-1,5 casi ogni 100.000
abitanti/anno, con un’età mediana all’esordio di 60-65 anni.
La MI deriva dalla
trasformazione in senso neoplastico di una cellula staminale emopoietica
totipotente. La proliferazione fibroblastica presente nel midollo di questi
soggetti non è interessata dal processo di espansione clonale dell’emopoiesi ma
è un fenomeno secondario. Questi fibroblasti sono però responsabili della
eccessiva produzione di fibre collagene a livello midollare, fenomeno che è
controllato da citochine rilasciate dalle cellule emopoietiche clonali
proliferanti.
Diagnosi
Attualmente la
diagnosi di MI si basa sui criteri stabiliti nel 2008 dalla World Health
Organization (WHO), che tengono conto di aspetti istopatologici, morfologici,
clinici e molecolari (Tabella 1).
|
Criteri maggiori:
1) Incremento
della fibrosi midollare reticolinica/collagena e/o iperplasia
megacariocitaria con atipie e iperplasia granuloblastica
2)
Assenza di segni diagnostici per LMC, PV, MI, SMD
3)
Positività della mutazione V617F di JAK-2 o di altri marker clonali o
assenza di cause
conosciute di mielofibrosi
secondaria
|
1) Splenomegalia palpabile
4) Aumento dei livelli sierici di LDH
|
Si pone diagnosi
di MI in presenza di tutti i criteri maggiori + 2 criteri
minori
|
L’istopatologia è
cruciale nella diagnosi di MI. Il midollo varia da un quadro molto cellulare
con scarsa fibrosi reticolinica a quadri in cui è assente l’emopoiesi normale
per la presenza di marcata infiltrazione fibrotica con osteomielosclerosi.
Accanto alla
fibrosi midollare gli aspetti istologici più caratteristici della MI, così da
porre diagnosi anche senza fibrosi midollare (MI “prefibrotica”), riguardano i
megacariociti. Le principali alterazioni dei megacariociti in corso di MI, che
permettono una diagnosi differenziale con la TE, sono l’iperplasia
megacariocitaria con atipie morfologiche e la formazione di aggregati (cluster)
“stretti”, a differenza dei cluster “lassi”presenti nella TE. Da ultimo, va
ricordata l’iperplasia granuloblastica che si associa al quadro sopra descritto
nella MI, mentre è generalmente assente o lieve nella TE.
Un altro criterio
fondamentale per la diagnosi è rappresentato dalla presenza della mutazione
V617F del gene JAK-2, da mutazioni della calreticulina (CALR) o dalla mutazione
W515L/K del gene MPL, presenti rispettivamente nel 60%, nel 20-25% e nel 5-10%
circa dei pazienti. Da segnalare la presenza nella MI anche di alterazioni
molecolari comuni ad altre emopatie (per esempio dei geni CBL, ASXL1, TET2 e
EZH2), che sembrano avere un importante significato prognostico.
Sintomatologia
Si può dividere
l’evoluzione della MI in 2 fasi successive: una fase “cellulare”, con fibrosi
midollare reticolinica, splenomegalia lieve/moderata e leuco-piastrinosi con
anemia assente o lieve, ed una fase “fibrotica”, con fibrosi midollare
collagena/osteomielosclerosi, splenomegalia ingravescente e progressiva
pancitopenia periferica con anemia.
Nei pazienti in
fase cellulare, il 60 – 70% sono asintomatici e la diagnosi è occasionale in
corso di analisi di routine o per il riscontro di una splenomegalia all’esame
obiettivo. Raramente, si osservano disturbi addominali, disturbi del
microcircolo per la leuco-piastrinosi e presenza di sintomi sistemici. Nei
pazienti in fase fibrotica, più dell’80% presentano sintomi: i più comuni sono
disturbi addominali (dolori da compressione, dispepsia e malassorbimento,
infarti splenici, ipertensione portale) per la splenomegalia, sintomi sistemici
(febbre, perdita di peso, sudorazione notturna, dolori ossei, prurito) e sintomi
legati alle citopenie periferiche. Nella fase cellulare, possono comparire
fenomeni trombotici legati alla leucopiastrinosi: nella fase fibrotica,
compaiono talvolta fenomeni emorragici ed infezioni recidivanti secondarie alla
piastrinopenia ed alla leucopenia.
Dati di laboratorio
Per l’
inquadramento di un paziente con MI, oltre agli esami diagnostici (biopsia ossea
e ricerca delle mutazioni di JAK-2/CALR/MPL), sono indispensabili i seguenti
esami: l’esame emocromocitometrico che permette di evidenziare l’anemia,
la leuco-piastrinosi della fase cellulare e le citopenie della fase fibrotica,
lo striscio periferico che permette di valutare la presenza di
eritroblasti e degli eritrociti “a lacrima” (dacriociti) caratteristici della
MI, LDH che è quasi sempre aumentato a conferma della diagnosi e
l’ecografia addominale che permette una corretta valutazione della
splenomegalia e dell’epatomegalia all’esordio e nel corso della malattia.
L’esame citogenetico e la conta degli elementi CD34+ nel periferico sono utili
esami complementari, il cui significato prognostico è stato di recente
evidenziato.
Decorso
Il decorso della
MI è in genere cronico protratto, con una sopravvivenza mediana di circa 5 anni:
tuttavia, il decorso della MI è molto eterogeneo, comprendendo pazienti a
sopravvivenza lunga (> 8 – 10 anni) accanto a pazienti con sopravvivenza assai
ridotta (< 2 – 3 anni). A distanza variabile dalla diagnosi, si osserva
un’evoluzione in CB nel 20 - 25% dei pazienti. Le principali cause di morte nei
pazienti con MI sono l’evoluzione in CB (30%), l’evoluzione in fase “accelerata”
senza trasformazione leucemica (20%), le trombosi (15%) e le infezioni (10%).
Valutazione prognostica
Avendo la MI un
decorso così eterogeneo, è importante attribuire ad ogni paziente un diverso
rischio prognostico per consentire un’adatta terapia. A tale scopo, sono stati
elaborati dei sistemi a “score”. Il più usato è l’International Prognostic
Scoring System (IPSS), basato su 5 diversi fattori: età >65 anni, Hb <10 g/dl,
globuli bianchi >25.000/mmc, blasti circolanti >1% e presenza di sintomi
sistemici. L’IPSS permette di identificare 4 gruppi di rischio con diversa
sopravvivenza.
Terapia
L’attuale
algoritmo terapeutico per i pazienti con MI è descritto nella Figura 1.
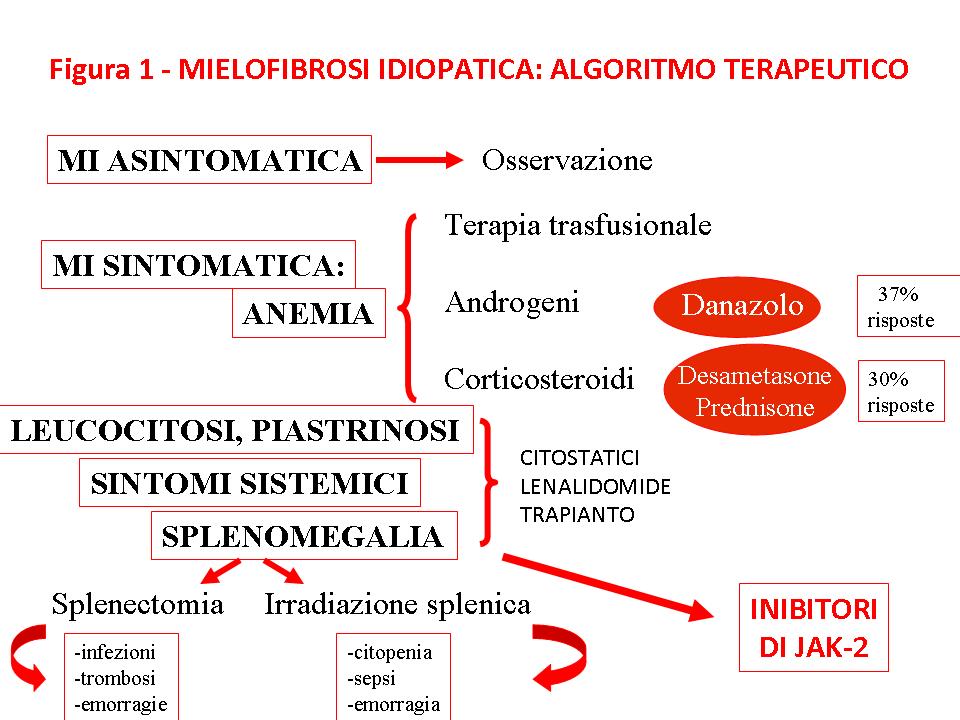 Nel
caso di pazienti con MI a basso rischio secondo l’IPSS generalmente non viene
utilizzato alcun trattamento; i pazienti sintomatici o con rischio alto secondo
l’IPSS ricevono trattamenti il cui scopo principale è quello di migliorare
l’anemia, ridurre la splenomegalia, eliminare i sintomi sistemici, ridurre la
trombocitosi e la leucocitosi.
Nel
caso di pazienti con MI a basso rischio secondo l’IPSS generalmente non viene
utilizzato alcun trattamento; i pazienti sintomatici o con rischio alto secondo
l’IPSS ricevono trattamenti il cui scopo principale è quello di migliorare
l’anemia, ridurre la splenomegalia, eliminare i sintomi sistemici, ridurre la
trombocitosi e la leucocitosi.
Gli approcci a
nostra disposizione per l’anemia oltre la terapia di supporto trasfusionale sono
gli androgeni che permettono di ottenere una risposta nel 20-30% dei
casi, i corticosteroidi, che permettono di controllare l’anemia nel 30%
dei casi e l’eritropietina che in numerosi studi si è dimostrata efficace
nel ridurre il fabbisogno trasfusionale.
Il farmaco di
scelta per il controllo della splenomegalia sintomatica resta l’idrossiurea
(HU) alla dose di 500-1500 mg/die. Le risposte si osservano di regola non
prima di 8-10 settimane in circa un 40% dei casi trattati. Nei pazienti di età <
45 anni può essere utilizzato anche l’α-interferone che si è dimostrato
utile come agente mielosoppressivo, anche se meno ben tollerato dell’HU e molto
più costoso.
La splenectomia
deve essere riservata solo a quei pazienti non rispondenti agli agenti
citotossici che presentano una notevole splenomegalia con ingombro addominale,
associata ad una grave anemia e/o piastrinopenia con ipertensione portale grave.
Un’alternativa alla splenectomia, per quei pazienti con
controindicazioni di tipo chirurgico e con un’adeguata conta piastrinica (>
50000/mmc), può essere la radioterapia splenica, che tuttavia consente
risposte di durata limitata nel tempo.
L’efficacia della
terapia convenzionale nel controllo dei sintomi sistemici è limitata: talvolta i
pazienti rispondono al trattamento corticosteroideo. Di recente, l’impiego di
farmaci ad azione inibitoria su JAK-2 ha mostrato una buona efficacia proprio
nel contenimento/risoluzione dei sintomi sistemici.
Il trapianto di
cellule staminali ha un potenziale effetto curativo nei pazienti
giovani (< 65 anni) affetti da MI, documentato da un attecchimento midollare
stabile e dalla scomparsa della fibrosi midollare in circa il 40 – 50% dei casi.
Data la tossicità di questa procedura (la mortalità correlata al trapianto
varia dal 15% al 48%), l’European Leukemia Net ha stabilito che il trapianto
debba essere preso in considerazione per quei pazienti nei quali la prognosi è
inferiore ai 5 anni di sopravvivenza, cioè coloro appartenenti alla categoria di
rischio alto o intermedio-2 dell’IPSS.
Terapia della
crisi blastica
La prognosi della
CB è infausta, con sopravvivenze raramente superiori ai 12 mesi, spesso
inferiori ai 6 mesi indipendentemente dal trattamento impiegato: di recente,
l’impiego dell’azacitidina (75 mg/mq per sette giorni ogni 4 settimane) in NMC
evolute in CB ha consentito di ottenere una percentuale di risposta del 38% ed
una sopravvivenza mediana di 8 mesi. Può pertanto essere considerata sia una
valida alternativa alla terapia di supporto che un trattamento di preparazione
al trapianto allogenico di cellule staminali.
Terapie
innovative
Diversi nuovi
agenti terapeutici sono in fase di valutazione, da soli o in combinazione fra
di loro. Fra questi, i più promettenti per il futuro sono gli inibitori di JAK
2, che hanno mostrato risultati incoraggianti nel controllo di due aspetti
clinici di difficile gestione nel decorso della MI, quali il controllo della
splenomegalia e la risoluzione dei sintomi sistemici. Allo stato attuale,
diverse molecole sono in corso di sviluppo clinico e tutte sembrano dare un
beneficio in termini di qualità di vita e riduzione della splenomegalia: in
particolare il ruxolitinib ha mostrato anche un vantaggio in termini di
sopravvivenza quando posto a confronto in 2 studi randomizzati al placebo o al
miglior trattamento disponibile.
U. RECINE, Direttore U.O.C.
Medicina Interna, Ospedale Santo Spirito in Sassia, Roma
Roberto Latagliata:
Dipartimento di Biotecnologie Cellulari ed Ematologia, “Sapienza” Università di
Roma
 Nel
caso di pazienti con MI a basso rischio secondo l’IPSS generalmente non viene
utilizzato alcun trattamento; i pazienti sintomatici o con rischio alto secondo
l’IPSS ricevono trattamenti il cui scopo principale è quello di migliorare
l’anemia, ridurre la splenomegalia, eliminare i sintomi sistemici, ridurre la
trombocitosi e la leucocitosi.
Nel
caso di pazienti con MI a basso rischio secondo l’IPSS generalmente non viene
utilizzato alcun trattamento; i pazienti sintomatici o con rischio alto secondo
l’IPSS ricevono trattamenti il cui scopo principale è quello di migliorare
l’anemia, ridurre la splenomegalia, eliminare i sintomi sistemici, ridurre la
trombocitosi e la leucocitosi.