IMAGING INTEGRATO
Prof Massimo Fioranelli
Nel 1957 Sones1
eseguì la prima coronarografia selettiva nell'uomo, dopo cinquant'anni dalla sua
introduzione, essa rimane un esame diagnostico insostituibile nella valutazione
della malattia coronarica. Tuttavia, nel corso degli ultimi anni, l'introduzione
di alcune tecniche di imaging coronarico hanno ridefinito i limiti e l'utilita'
di questa metodica2, soprattutto in termini di quatificazione del
grado di stenosi3.
Nel 2009 in Italia, sono state
eseguite 265.794 esami coronarografici a fronte di 132.670 angioplastiche
coronariche (dati della Societa' Italiana di Cardiologia Interventistica –GISE-),
mettendo in luce come in 50% circa degli esami eseguiti non è vi è stata alcuna
procedura di rivascolarizzazione 4. Una stenosi coronarica può
essere identificata essenzialmente da due punti di vista: per la riduzione
della sezione, del calibro
o del lume del vaso (da
un punto di vista squisitamente anatomopatologico
o di immagini di Tomografia Computerizzata -TC-)
o per la riduzione del diametro, in senso longitudinale (da un
punto di vista prettamente angiografico) Nei referti coronarografici ci si
riferisce usualmente alla riduzione percentuale del diametro5. La
stenosi coronarica, osservata da un punto di vista angiografico, quindi
biplanare, viene valutata con
i seguenti parametri: la
percentuale di stenosi ed il diametro minimo del lume (MLD).
La valutazione della percentuale
di stenosi si ottiene dal rapporto tra il diametro minimo del lume a livello
del punto più stretto della lesione ed il diametro di riferimento, che risulta
dalla media dei diametri del lume nei segmenti di riferimento a monte ed a valle
della stenosi, giudicati apparentemente sani3.
Il diametro minimo del lume è
espresso in millimetri e, rispetto alle percentuali di stenosi, è una variabile
assoluta e più facilmente riproducibile.
Si definisce una stenosi
emodinamicamente significativa quella in grado di ridurre di almeno il 50% il
diametro di un vaso coronarico. Questo, comunque, non significa che quella
particolare lesione sia in grado di determinare ischemia, ma solamente che una
data percentuale di riduzione è la condizione minima essenziale per cui si
possa avere un potenziale ischemico. Il flusso basale non subisce tuttavia
alcuna riduzione fino a che non venga ridotto a circa il 90% il diametro
dell'arteria. In assenza di un aumento del tono muscolare coronarico, di
ipertrofia, o di tutte quelle condizioni che determinino una disfunzione del
microcircolo, è necessaria una stenosi in genere severa per limitare il flusso
coronarico massimale durante uno sforzo6.
In molti soggetti con malattia
coronarica la decisione di eseguire una procedura di rivascolarizzazione deve
essere basata non solo sull'aspetto anatomico, ma anche sulla severità
funzionale della stenosi (test funzionali non invasivi). Quando è presente una
lesione coronarica di moderata entità, tra il 50 e l'80%, ed i test provocativi
non invasivi dimostrano un'ischemia miocardica, nel caso in cui la terapia
medica sia inefficace nel controllare i sintomi, è indicata una procedura di
rivascolarizzazione miocardica. Nel caso, invece, in cui i test non invasivi
non mostrino ischemia, nonostante il persistere di dolore toracico, è utile
avere una valutazione funzionale della stenosi. La fractional flow reserve(FFR)6
rappresenta un indice funzionale attendibile nella valutazione di una stenosi
coronarica. La FFR identifica il flusso massimale miocardico nel territorio di
distribuzione di un'arteria coronarica in presenza di una stenosi rapportato al
flusso massimo teorico. Viene calcolato il gradiente di pressione
trans-stenotico, dopo aver somministrato adenosina per via intracoronarica od
endovenosa, ottenendo quindi la massima vasodilatazione a valle di una placca.
Il valore viene calcolato dal rapporto della pressione registrata a valle di una
stenosi diviso quello riscontrato a monte. L'indice nornale è uguale ad 1.
Viene considerato anomalo un valore inferiore allo 0,757. Un altro
metodo per valutare la componente funzionale di una stenosi è lo studio della
velocità di flusso, a monte ed a valle, con l'utilizzo di una sonda Doppler
(Doppler flow velocity). La variazione di velocità è proporzionale alla
variazione di flusso, nell'assunto che il calibro dell'arteria sia costante8.
Limiti dell’angiografia
coronarica
L'angiografia coronarica pur
essendo considerato l’esame più accurato per lo studio dell’albero
coronarico,presenta tuttavia dei limiti legati al fatto che la malattia
aterosclerotica si sviluppa essenzialmente nella parete del vaso9,
ed essa rileva un'immagine del lume vasale che si riempie di liquido di
contrasto (luminogramma). Studi anatomopatologici e dati di ecografia
intravascolare coronarica (IVUS) hanno consistentemente dimostrato che tratti di
arterie coronariche angiograficamente "normali" spesso contengono un
significativo carico aterosclerotico. La stenosi coronarica viene definita in
base alla riduzione percentuale del diametro del vaso in rapporto ad un
segmento a monte ed a valle, considerati apparentemente normali. L'entità della
stenosi può quindi essere spesso sottostimata quando vi sia un processo
degenerativo aterosclerotico diffuso che riduce in toto il calibro del vaso10.
Un altro limite della
valutazione angiografica e' determinato dal processo di rimodellamento positivo,
descritto da Glacov; processo per cui il diametro del vaso si ingrandisce per
contrastare la riduzione del calibro prodotto dalla placca aterosclerotica.
Numerosi
trials
hanno dimostrato che la maggior parte delle trombosi
coronariche si verificano su una placca non ostruttiva e spesso si formano su
placche che presentano stenosi da lievi a moderate, inferiori al 75%. D'altro
canto l'infarto miocardico spesso è il risultato della rottura di una placca
vulnerabile che non determina alcuna riduzione del lume coronarico. Nonostante
l'usuale acquisizione di immagini da diverse angolazioni, spesso le lesioni
sono eccentriche e quindi di difficile valutazione;
inoltre l'entità e la severità
di una stenosi coronarica presenta una marcata variabilità inter ed
intraosservatore. La presenza di queste limitazioni metodologiche, la necessità
di misurare il carico aterosclerotico e l'analisi della composizione della
placca ha favorito lo sviluppo di tecniche di imaging integrato in sala di
emodinamica quali l'IVUS (IntraVascularUltrasound)11 e l'OCT (Optical
ChoerenceThomography)12.
IVUS
L'ecografia intravascolare
coronarica (IVUS) è una tecnica di imaging che, attraverso l'utilizzo degli
ultrasuoni, permette lo studio a 360° dei vasi coronarici epicardici mediante
valutazione ecografìca intraluminale13 e quindi, un'analisi del vaso
arterioso coronarico indipendente dall'angolo di proiezione. Questa tecnica,
quindi, fornisce un'immagine diretta e in tempo reale dell'ateroma14.
L'acquisizione delle immagini
IVUS richiede l'incannulazione del vaso prescelto con un catetere guida ed il
successivo inserimento di un filo guida per angioplastica su cui fare avanzare
la sonda ultrasonografica (sono disponibili sonde di tipo meccanico ed
elettronico). La sonda viene posizionata distalmente alla lesione coronarica che
si vuole studiare e quindi ritirata in senso distale-prossimale fino all'ostio
del vaso, in modo da ottenere una successione di immagini trasversali dei vasi
coronarici15.
L'acquisizione delle immagini
IVUS può essere effettuata sia manualmente che ricorrendo ad una trazione
automatica del catetere (pull-back automatico), applicando una velocità
costante pari a 0.5 o 1 mm/sec.
L'IVUS è quindi una metodica
invasiva, quanto la coronarografia, che consente di studiare solo un ramo
coronarico per volta, 16.
La valutazione IVUS di una
lesione coronarica è una procedura sicura che comporta una bassa incidenza di
complicanze. Le dimensioni del vaso arterioso sono determinate dall'area
delimitata dalla membrana elastica esterna ed il lume delimitato dal bordo
dell'intima: tale area è definita Cross Sectional Area (CSA) della
placca17.
Studi di validazione istologica
hanno dimostrato che la placca aterosclerotica può essere classificata in
lesioni a composizione prevalentemente lipidica, fibrosa o calcifica18.
Quindi, sulla base dell'ecogenicità delle strutture analizzate, l'IVUS consente
di identificare tre tipi di placca:
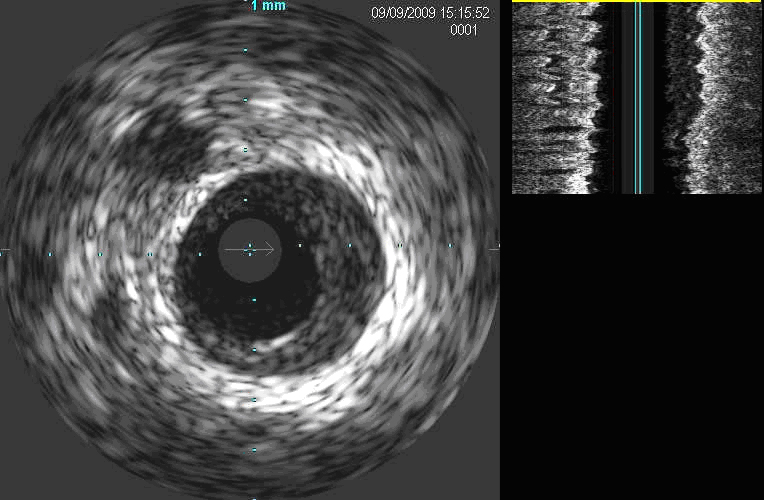
1) placca ipoecogena, o soffice,
caratterizzata da ecoriflettenza diversa da quella della membrana elastica
esterna (Fig. 1);
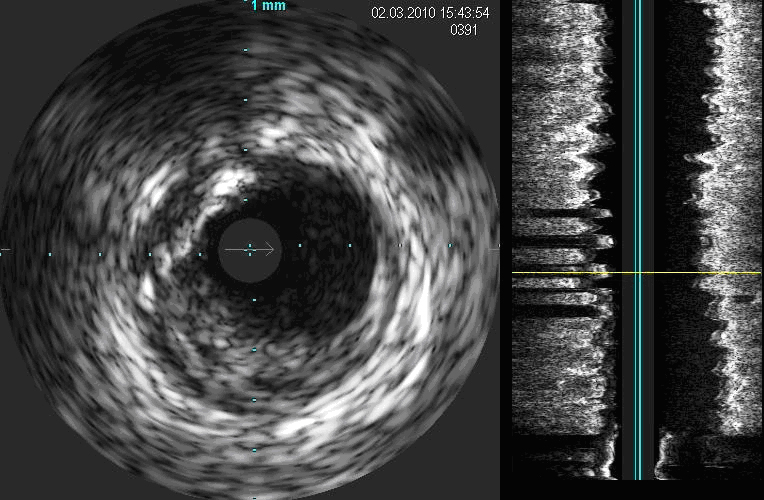
2) placca fibrosa, con
ecoriflettenza simile a quella dell'avventizia e caratterizzata da un alto
contenuto di collagene ed elastina (Fig. 2);
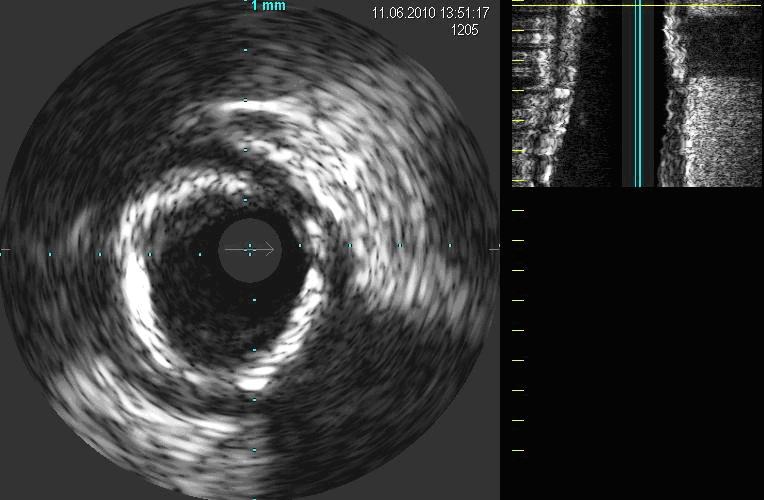
3) placca calcifica,
ecoriflettente con cono d'ombra (Fig. 3).
C’è da dire, però, che sebbene
l'IVUS identifichi con alta sensibilità e specificità il tessuto fibroso e
calcifico, la metodica risulta meno accurata nell'identificare il tessuto
lipidico19. Per quanto riguarda
i depositi di calcio,
invece, l'IVUS presenta una sensibilità ed una specificità significativamente
superiore all'angiografia.
Gli studi con IVUS nei pazienti
sottoposti ad angioplastica coronarica hanno dimostrato che l'aterosclerosi
coronarica è presente in oltre il 90% dei pazienti, anche in quei vasi che
appaiono normali alla coronarografia.
Varie sono le applicazioni
diagnostiche dell'IVUS: la valutazione della composizione della placca, la
misura del grado di stenosi, la valutazione del diametro vasale; tutto cio' ci
orienta in modo più preciso dell’angiografia sulla scelta del tipo di stent da
utilizzare per l'angioplastica. Tale tecnica è inoltre utile nella valutazione
di lesioni coronariche angiograficamente subcritiche, in particolar modo quelle
a localizzazione ostiale, alle biforcazioni e quelle a carico del tronco comune20.
Virtual Histology
L'analisi del segnale
radiofrequenza, analisi della scala dei grigi all'analisi dei segnali acustici
in radiofrequenza (RF IVUS) si è dimostrata in grado di migliorare il contributo
informativo dell'IVUS, definendo con maggior precisione la morfologia e la
composizione della placca aterosclerotica. L'analisi spettrale dei segnali e'
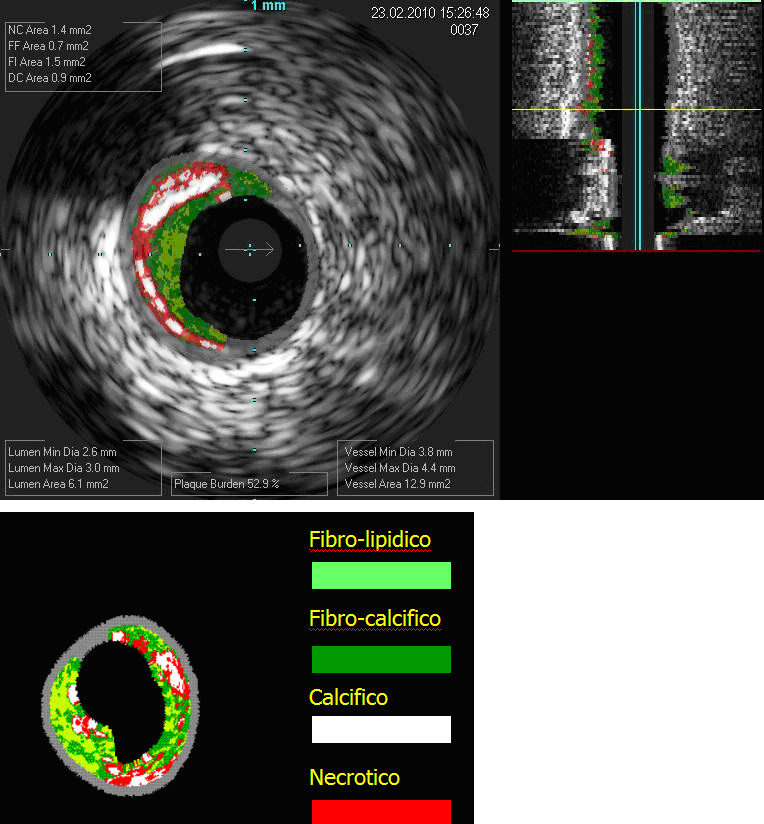
stata definita Virtual Histology14. Sono stati codificati dei colori
per caratterizzare le varie componenti istologiche: in verde il tessuto fibroso,
in giallo il tessuto fibro-lipidico in bianco il calcio e il rosso per il corpo
lipidico necrotico (vedi figura 4). Si creano cosi' mappe tissutali della
sezione trasversa della placca. La Virtual Histology pertanto rappresenta un
surrogato dell'istologia nello studio dell'aterosclerosi in vivo.
Le complicanze cui può andare
incontro una placca aterosclerotica9, indipendentemente dal suo
grado di stenosi, sono essenzialmente rappresentate dalla rottura del cappuccio
fibrotico superficiale (fibrous
cap)
o
dall'erosione, cioè dalla perdita del tessuto endoteliale di rivestimento. Tutto
questo predispone alla formazione di trombi e quindi all'istantanea riduzione
del lume vascolare. Dal punto di viata istopatologico, sono vulnerabili, ossia a
potenziale rischio di instabilizzazione, le placche con ampio nucleo (core)
lipidico, sottile cappuccio fibroso (< 65µ) , abbondante quota di cellule
infiammatorie e ricchezza di metalloproteasi
Accanto a questa definizione vi
è quella di fibroateroma con sottile cappuccio fibrotico infiammato
(inflammed Thin-cap Fibroatheroma, TCFA).
È stata evidenziata una
relazione tra l'estensione del core lipidico e la vulnerabilità della
placca aterosclerotica: un ampio core lipidico correla con una maggiore
probabilità di rottura della placca e pertanto di trombosi coronarica acuta.
Uno dei fattori che condiziona
la tendenza alla rottura della placca aterosclerotica è lo spessore della
capsula fibrosa: quanto maggiore è lo spessore, tanto minore è la possibilità di
rottura della placca.
In genere le lesioni
aterosclerotiche responsabili dell'infarto presentano una capsula fibrosa
sottile, con spessore inferiore a 65µ, ed un nucleo lipidico sottostante ben
sviluppato. È stata inoltre osservata una peculiare distribuzione geografica
della placca aterosclerotica ad alto rischio10; le regioni prossimali
e medie delle principali arterie coronarie sono quelle più frequentemente sede
di placche vulnerabili. Inoltre in uno stesso paziente vi è spesso più di una
placca vulnerabile
Sintetizzando queste sono le
principali caratteristiche delle placche vulnerabili:
·
presenza di un
sottile cappuccio fibroso (<65µ);
·
esteso pool
lipidico centrale;
·
presenza di abbondante infiltrato infiammatorio in corrispondenza del
cappuccio fibroso.
Pur se il RF IVUS è una metodica
in grado di rilevare con accuratezza i pool lipidici che com'è noto sono un
elemento predittivo di vulnerabilità di placca, la metodica presenta alcuni
limiti in quanto la risoluzione laterale è superiore ai 200 micron per cui non è
possibile rilevare una capsula fibrosa assottigliata ovvero di spessore
inferiore ai 65µ.
In base a queste limitazioni e'
stata introdotta una sorta di microscopia ottica biologica con maggior potere
di risoluzione come l'OCT.
Tomografia a Coerenza Ottica (OCT)
La tomografia a coerenza ottica
(Optical CoherenceTomography)21e' una tecnologia di imaging ad alta
risoluzione che utilizza una sorgente di luce vicina alla radiazione
infrarossa (near infrared light, lunghezza d'onda compresa tra 1280 e 1350 nm)
per visualizzare le strutture biologiche all'interno di un tessuto attraverso la
riflessione delle radiazioni ottiche. La riflessione del fascio di luce genera
immagini ad alta risoluzione delle pareti vasali e delle lesioni coronariche.
Una sottile fibra ottica (0,019 inches) viene inserita all'interno delle
coronarie durante un tradizionale esame coronarografico22. La luce
riflessa viene comparata a un fascio luminoso di riferimento, relativo ad una
lunghezza predefinita e così si ottengono immagini con una risoluzione
nettamente superiore a quelle ultrasonografiche (IVUS); la risoluzione spaziale
è infatti pari al 10-15 micron, 30 volte superiore a quella del IVUS.
Con l'OCT si evidenziano i tre
strati della parete coronarica: l'intima, la media e l'avventizia (Figura 5)23.
La risoluzione dell’OCT consente
di evidenziare le due strutture che delimitano la media: la lamina elastica
interna e l'esterna.. In presenza di una placca complicata l'OCT e' in grado di
rilevare il trombo, che appare come una massa ecoriflettente all'interno del
lume24. Le dissezioni o fissurazioni di placca si apprezzano come
sottili lembi di tessuto e sono di usuale riscontro nei soggetti con sindrome
coronarica acuta. Infine l’OCT è potenzialmente in grado di evidenziare i
vasavasorum che irrorano la placca aterosclerotica, che a loro volta possono
essere responsabili della complicazione di una placca. L'OCT permette accurate
misurazioni delle aree e dei diametri luminali. In presenza di un pool lipidico
è possibile misurare la capsula fibrosa che lo delimita internamente e lo
spessore e l'area della formazione lipidica. L’OCT offre preziose informazioni
relativamente alla corretto impianto di uno stent. Definisce l'esatta
localizzazione delle maglie dello stent ed una eventuale incompleta apposizione
delle maglie. Infatti la risoluzione elevata della tecnica consente sempre di
misurare la distanza tra le maglie dello stent e la parete dell'arteria25.
Il limite dell’OCT è che la luce
ad infrarossi emessa possiede una bassa penetrazione, rendendo impossibile lo
studio delle componenti della placca ad una profondità superiore ad 1-1.5 mm.
Oggi, in piena era di imaging
coronarico, le nuove metodiche non invasive come la TC coronarica, e quelle
invasive, che affiancano la tradizionale angiografia coronarica, come l'IVUS ed
l’OCT26, hanno segnato un punto di svolta nell'interpretazione della
malattia coronarica, consentendoci di vedere più a fondo e nel dettaglio.
FIGURE
 |
 |
|
Figura 1 - Placca
ipoecogena |
Figura 2 - Placca
fibrosa con alcune componenti calcifiche |
 |
 |
|
Figura 3 - Placca calcifica concentrica |
Figura 4 - Virtual histology: placca fibrocalcifica. in verde chiaro:
tessuto fibroso, in verde scuro: tessuto fibro-calcifico, in bianco:
calcio; in rosso: tessuto necrotico. |
 |
|
Figura 5 -
Immagine OCT. Si riconoscono i tre strati della parete arteriosa:
intima, media ed avventizia.In verde l'area luminale.In bianco il
cappuccio superficiale. |
Bibliografia:
1. HG Kemp, RA
Kronmal, RE Vlietstra, and RL FryeSeven
year survival of patients with normal or near normal coronary arteriograms: a
CASS registry study.J Am CollCardiol 1986 7: 479-483
2. Seymour Glagov, M.D., Elliot
Weisenberg, B.A., Christopher K. Zarins, M.D., Regina Stankunavicius, M.P.H.,
and George J. KolettisCompensatory Enlargement of
Human Atherosclerotic Coronary Arteries.
B.A.N Engl J
Med 1987; 316:1371-1375
3. Gould KL,
Kirkeeide RL, Buchi M. Coronary flow reserve as aphysiologic measure of stenosis
severity. J Am CollCardiol 1990;15:459–74
4. Eric J. Topol,
MD; Steven E. Nissen, MD.Our Preoccupation With
Coronary Luminology.The Dissociation Between Clinical
and Angiographic Findings in Ischemic Heart Disease .Circulation.
1995;92:2333-2342
5.
Falk E, Shah PK, Fuster V. Coronary plaque
disruption. Circulation. 1995 Aug 1;92(3):657-71.
6. De Bruyne B,
Bartunek J, Sys SU Simultaneous coronary pressure and flow velocity mesaurement
in humans. Feasibility, reproducibility and hemodynamic dependance of coronary
flow velocity reserve , hyperemic flow verus pressure sloop index and fractional
flow reserve.Circulation 1996;94:1842-1849
7. Manesh R.
Patel, M.D., Eric D. Peterson, M.D., M.P.H., David Dai, M.S., J. Matthew
Brennan, M.D., Rita F. Redberg, M.D., H. Vernon Anderson, M.D., Ralph G.
Brindis, M.D., and Pamela S. Douglas, Low Diagnostic Yield of Elective Coronary
Angiography M.D. N Engl J Med 2010;362:886-95
8.Pim A.L.
Tonino, William F. Fearon, Bernard De Bruyne, Keith G. Oldroyd, Massoud A.
Leesar, Peter N. Ver Lee, Philip A. MacCarthy, Marcel van't Veer, and Nico H.J.
Pijls. J. Am. Coll. Cardiol. 2010;55;2816-2821 Angiographic Versus Functional
Severity of Coronary Artery Stenoses in the FAME Study: Fractional Flow Reserve
Versus Angiography in Multivessel Evaluation
9.Burke AP, Farb A, Malcom GT Coronary
risk factors and plaque morphology in men with coronary disease who died
suddenly. N Engl J Med 1997;336:1276–82.
10. Schaar JA, Muller JE, Falk E
Terminology for high-risk and vulnerable coronary artery plaques. Report of a
meeting on the vulnerable plaque. Eur Heart J 2004;25:1077– 82.
11.Yabushita H, Bouma BE, Houser SL.
Characterization of human atherosclerosis by optical coherence tomography.
Circulation. 2002 Sep 24;106(13):1640-5.
12. Popma JJ.
Coronary angiography and intravascular ultrasound imaging. In: ZipesDP,Libby P,
Bonow RO, Braunwald E, eds. Braunwalds Heart disease. Philadelphia:Elsevier
Saunders, 2005:423-455.
13. American
College of Cardiology.Clinical Expert Consensus Document on Standards for
Acquisition, Measurement and Reporting of Intravascular Ultrasound Studies
(IVUS). JACC Vol. 37, No. 5, 2001;1478–92.
14. Takashi
Kubo, Akiko Maehara, Gary S. Mintz, Hiroshi Doi, Kenichi Tsujita, The Dynamic
Nature of Coronary Artery Lesion Morphology Assessed by Serial Virtual
Histology Intravascular Ultrasound Tissue Characterization J. Am. Coll. Cardiol.
2010;55;1590-1597
15Tearney GJ, Waxman S, Shishkov M.
Three-dimensional coronary artery microscopy by intracoronary optical frequency
domain imaging. J Am CollCardiolImg 2008;1:752– 61
16. Di Mario C,
Görge G, Peters R, Kearney P, Pinto F, Hausmann D, von Birgelen C, Colombo A,
Mudra H, Roelandt J, Erbel R
Clinical
application and image interpretation in intracoronary ultrasound. Study Group on
Intracoronary Imaging of the Working Group of Coronary Circulation and of the
Subgroup on Intravascular Ultrasound of the Working Group of Echocardiography of
the European Society of Cardiology..
Eur Heart J. 1998 Feb;19(2):207-29
17.Nissen SE,
YockP.Circulation. 2001 Jan
30;103(4):604-16
Intravascular ultrasound: novel pathophysiological insights and current clinical
applications.
18 Gussenhoven
EJ, Essed CE, Frietman P, van Egmond F, Lancée CT, van Kappellen WH, Roelandt J,
Serruys PW, Gerritsen GP, van Urk H, et al.Eur J Vasc Surg.
Intravascular ultrasonic imaging: histologic and echographic correlation.1989
Dec;3(6):571-6
19.Gussenhoven
EJ, Essed CE, Lancée CT, Mastik F, Frietman P, van Egmond FC, Reiber J, Bosch H,
van Urk H, Roelandt J, et al.
Arterial
wall characteristics determined by intravascular ultrasound imaging: an in vitro
study.J Am CollCardiol.
1989 Oct;14(4):947-52.
20. Potkin BN,
Bartorelli AL, Gessert JM, Neville RF, Almagor Y, Roberts WC, Leon MB.
Coronary
artery imaging with intravascular high-frequency ultrasound.Circulation.
1990 May;81(5):1575-85.
21Yamaguchi T, Terashima M, Akasaka T
Safety and feasibility of an intravascular optical coherence tomography image
wire system in the clinical setting. Am J Cardiol. 2008 Mar 1;101(5):562-7
22.Bezerra HG, Costa MA, Guagliumi G.
Intracoronary optical coherence tomography: a coomprehensive review clinical and
research applications. JACC CardiovascInterv 2009 Nov 2 (11): 1035-46
23.Yabushita H,
Bouma BE, Houser SL, Aretz HT, Jang IK, Schlendorf KH, Kauffman CR, Shishkov M,
Kang DH, Halpern EF, Tearney GJ
Characterization of human atherosclerosis by optical coherence tomography.Circulation.
2002 Sep 24;106(13):1640-5.
24. Prati F,
Regar E, Mintz GS, Arbustini E, Di Mario C, Jang IK, Akasaka T, Costa M,
Guagliumi G, Grube E, Ozaki Y, Pinto F, SerruysPW;Expert
review document on methodology, terminology, and clinical applications of
optical coherence tomography: physical principles, methodology of image
acquisition, and clinical application for assessment of coronary arteries and
atherosclerosis.
Expert's OCT
Review Document. Eur Heart J. 2010
Feb;31(4):401-15.
25Bouma
BE, Tearney GJ, Yabushita H. Evaluation of intracoronary stenting by
intravascular optical coherence tomography.
Heart 2003; 89, 317–321.
26.
Capodanno D, Prati F, Pawlowsky T, Cera M, La Manna A, Albertucci M, Tamburino
C.) Comparison of optical
coherence tomography and intravascular ultrasound for the assessment of in-stent
tissue coverage after stent implantation. EuroIntervention. 2009
Nov;5(5):538-43..
Corrisponding
Author
Prof. Massimo Fioranelli MD.
FESC, FCCP, FGISE, FANMCO.
Responsabile Centro Cuore
Casa di Cura Mater Dei,
Via A. Bertoloni 34, 00183 Roma
Tel.
+39 06 802206007
Fax.+39 06
80844556
e-mail:massimo.fioranelli@gmail.com;
massimo.fioranelli@materdei.it;
massimo.fioranelli@poste.it
www.coronarie.it
Direttore Scientifico
Centro Studi in Scienze della
Vita
Universita' Guglielmo Marconi
Via Plinio, 44 - 00193 Roma
Tel.: (+39 06) 37725 346
Fax: (+39 06) 37725 329
E-mail:
scienzedellavita@unimarconi.it
massimo.fioranelli@gmail.com






