Evidenze scientifiche delle Citochine Low Dose nelle principali patologie croniche
G. Di Paolo
La Medicina Fisiologica di Regolazione nasce da un’idea: ripristinare la Fisiologia attraverso molecole di relazione quali ormoni, interleuchine, fattori di crescita e neuropeptidi in low dose fisiologica, che corrispondono alla medesima concentrazione alla quale esse sono presenti a livello dei recettori transmembrana nella matrice extra-cellulare.
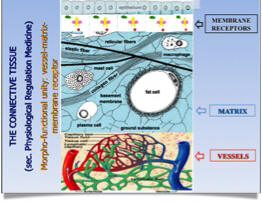
I pivot della Medicina Fisiologica di Regolazione sono i messangersmolecules che sono i messaggeri, le parole usate dai tre grandi sistemi di controllo omeostatico per “dialogare” l’un l’altro. L’importanza del connettivo nella medicina fisiologica di regolazione è data dalla sua funzionalità e composizione; infatti esso è inteso come un’unita’ morfo-funzionale comprendente la rete dei capillari, la matrice e il recettore di membrana.
Il connettivo è il vero “Sistema di Regolazione di Base”: tutte le modificazioni del nostro ambiente esterno ed interno influiscono, attraverso la sostanza fondamentale, sui meccanismi cellulari.
E’ attraverso la matrice connettivale che avviene la comunicazione fra cellule e ambiente esterno: è enorme la quantità d’informazioni che possono essere immagazzinate nella matrice e trasmesse alle cellule come istruzioni per il loro fisiologico funzionamento. E’ in essa che si terminano le giunzioni neurovegetative; è qui che per il tramite di sostanze neurali ed endocrine, e citochine, viaggiano le informazioni di natura psico-neuro-endocrino-immunologica che ne coordinano econtrollano il funzionamento attraverso il binding con i recettori di membrana.

(FIG.1)Un accumulo di stressors a questo livello rappresenta l’innesco potenziale per l’esordio e il progredire di un processo patologico.
Un ruolo fondamentale è giocato dal recettore di membrana.
Non è tanto, e solo, importante la quantità di ligando (ormone, citochina o neurotrasmettittore) quanto la capacità dei recettori di legare queste molecole, cioè la loro affinità.
Si pensi ai casi della leptinanell’obesità, o dell’insulina nelle forme di diabete insulino-resistenti, o dell’IL1 nelle forme infiammatorie croniche.
Solo la concentrazione fisiologica è in grado di attivare o riattivare i recettori di membrana e quindi la corretta funzione di una cellula bersaglio.L’affinità di un recettore per la propria citochina o per il proprio ormone è elevatissima.
La costante di dissociazione (KD) è dell’ordine di 10-9-10 –12M
In molti casi la DOSE della citochina decide il tipo di effetto biologico (es: IL-1 o TNF-alfa a 10-9 M= innesco processo infiammatorio; IL-1 o TNF-alfa a 10-7 M= shock settico).
Quindi quando parliamo di LowDoses, si tratta di sostanze a bassissima concentrazione che entrano in competizione con le sostanze presenti a livello di membrana e interagiscono con essa. Fondamentale, dunque, è la risposta di una cellula al ligando che dipende dal numero di recettori occupati.
Una normale cellula ha solitamente da 100 a 1000 recettori.
L’attivazione del 10% (oggi si pensa addirittura l’1-2%) dei recettori di membrana stimola la cellula per una funzione pari al 50% della sua potenzialità. Il meccanismo d’azione delle citochine omeopatizzate e degli ormoni omeopatizzati consiste nel sensibilizzare o attivare qualche unità di recettori cellulari o plasmatici [in virtù della loro estrema diluizione, la stessa con cui queste sostanze lavorano fisiologicamente: [(microgrammo) 10-6- (nanogrammo) 10-9 per le citochine e il picogrammo, 10-12 per gli ormoni]. Questa sensibilizzazione dei recettori consente che si inneschino reazioni a catena (sistemi complessi) con una ripresa della funzione biologica dell’intero network neuro-immuno-endocrino.Ormoni e citochine omeopatizzate funzionano portando al sistema un’informazione in grado di attivare meccanismi di autoregolazione.
Un eccesso di ligando determina la down regulation dei recettori di membrana.
Questo è da intendersi come un meccanismo di conservazione dell’omeostasi: infatti la cellula, per mantenere il proprio equilibrio di funzione, chiude i propri recettori, ma questo porta, dapprima ad un rallentamento della funzione e, poi, alla perdita.
Per esempio: nel caso di un’infiammazione acuta protratta, viene prodotta una quantità eccessiva di TNF-α e IL1; le cellule bersaglio dopo una prima risposta adeguata tendono a non rispondere più e, quindi, a “vicariare” verso una non-risposta infiammatoria (opportuna) con evoluzione del quadro verso la cronicizzazione. Altro esempio paradigmatico è quello dell’ IL6 nell’artrite reumatoide.
Tutto ciò porta a concludere che ogni processo patologico o malattia, non è altro che l’espressione e la conseguenza di mutate concentrazioni di molecole di relazione a livello delle transmembrane.
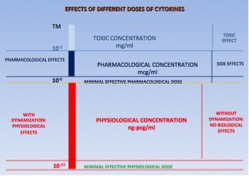
FIG.2

FIG.3
Equivalenza tra concentrazioni delle low dose e quantità ponderabile
Poiché citochine diverse possono avere effetti diversi sulla stessa cellula, ovvero una citochina può antagonizzare l’effetto di un’altra (es. IL4/INF gamma), dirette entrambe sulla stessa cellula, nel metodo della Medicina di Regolazione si tendono a utilizzare citochine antagoniste per frenare un effetto biologico e non differenti diluizioni della medesima citochina (al momento attuale non abbiamo evidenze sperimentali ma alcuni riscontri clinici).
Interessante sono degli studi portati avanti da più di una ricerca per confermare l’efficacia di tale tesi e per introdurre il concetto di equilibrio, usando citokine a basse dosi attivate con il metodo SKA® (SequentialKineticActivation).
Il lavoro di Bettelli E. e del suogruppo, dal titolo: ” Th17: the third member of the effector T cell trilogy”, pubblicatosu: “Current Opinion in Immunology 2007, 19”, è molto interessantepoichèdimostra come lo sviluppodi sottoinsiemiThregolal’espansione e le funzioni di ognialtrogruppo.
Mentre l' IL-4 stimolaildifferenziamentodei Th2 antagonizzando la differenziazionedelle cellule Th1, e l’IFN-γ stimola la differenziazionedei Th1 e inibisce lo sviluppodelle cellule Th2, entrambe le citochineantagonizzano lo sviluppo di Th17.
Ecco perchè per quanto riguarda le citochine è utile ragionare in termini di bilancia, soprattutto di bilanciamento dei Th1-Th2.
Nelle patologie si osserva uno sbilanciamento di uno dei due piatti della bilancia; per esempio, nelle patologie infiammatorie acute “pende” il piatto Th1 della bilancia: in questi casi la terapia dovrà consistere nell’ “aumentare” il peso del piatto Th2 (IL4, IL10, TGF beta) per riequilibrare la bilancia.
Invece, nelle patologie allergiche “pende” il piatto Th2; in questi casi la terapia dovrà consistere nell’aumentare il peso del piatto Th1 per riequilibrare la bilancia (IL12, INF gamma).
Le opportune citochine“riequilibratrici” svolgeranno la loro azione lavorando sui recettori cellulari.
Questo lavoro ci aiuta a capire molto bene il lavoro volto dalle citochine low-doses; il titolo è “Low dose oral administration of cytokines for treatment of allergic asthma”, pubblicato da“Pulmonary, Pharmacology and Therapeutics, Volume 22, Number 6, pp 497-510, December 2009” daiseguenti AA:Silvia Gariboldi, Marco Palazzo, Laura Zanobbio, Giuseppina F Dusio, Valentina Mauro, Umberto Solimene, Diego Cardani, Martina Mantovani, Cristiano Rumio.
Lo scopo è stato quello di verificare, attraverso una somministrazione orale di IL-12 + IFN-gamma a basse dosi, il trattamento, in modello murino, dell’ asma allergica e di risolvere la conseguente iperreattività bronchiale (BHR). L’attività anti-asmaticaper 8 - 15 giorni, confermata dalle analisi istologiche dei polmoni e dalle cellule del lavaggio broncoalveolare, è convincente per questo studio su modello murino.
L’effetto protettivo dell’associazione di Interleuchine a bassi dosaggi fisiologici attivati è eclatante e lascia supporre una possibile applicazione clinica quantomeno nel rallentamento della progressione della patologia.
Tali lavori ci aiutano e ci permettono di investigare un campo fisiologicoterapeutico ancora inesplorato, ma ricco di potenzialità nel campo della diagnosi e delle risoluzioni di molte patologie croniche a cui tanti nostri pazienti sono ancora in attesa di risposte.
BIBLIOGRAFIA ESSENZIALE
[1] Holgate ST, Polosa R. Treatment strategies for allergy and asthma. NatRevImmunol 2008;8(3):218–30.
[2] Kaiko GE, Horvat JC, BeagleyKW, Hansbro PM. Immunologicaldecision-making:howdoes the immune system decide to mount a helper T-cellresponse?Immunology 2008;123(3):326–38.
[3] Lafaille JJ. The role of helper T cellsubsets in autoimmune diseases. CytokineGrowthFactorRev 1998;9(2):139–51.
[4] Seder RA, Paul WE. Acquisition of lymphokine-producingphenotype by CD4+ T cells. AnnuRevImmunol 1994;12:635–73.
[5] Mosmann TR, Coffman RL. TH1 and TH2 cells: different patterns of lymphokine secretion lead to different functional properties. AnnuRevImmunol1989;7:145–73. doi:10.1146/annurev.iy.07.040189.001045.
[6] Coffman RL, Varkila K, Scott P, Chatelain R. Role of cytokines in the differentiation of CD4+ T-cellsubsets in vivo. ImmunolRev 1991;123:189–207.
[7] Marinaro M, Boyaka PN, Jackson RJ, Finkelman FD, Kiyono H, Jirillo E, et al. Use ofintranasal IL-12 totargetpredominantlyTh1 responses tonasal andTh2 responsesto oralvaccinesgiven with choleratoxin. J Immunol 1999;162(1):114–21.
[8] Marinaro M, Boyaka PN, Finkelman FD, Kijono H, Jackson RJ, Jirillo E, et al. Oralbutnotparenteralinterleukin (IL)-12 redirects T helper 2 (Th2)-typeresponses to an oral vaccine withoutalteringmucosalIgAresponses. ExpMed 1997;185(3):415–27.
[9] Lee SY, Huang CK, Zhang TF, Schofield BH, Burks AW, Bannon GA, et al. Oraladministration of IL-12 suppressesanaphylacticreactions in a murine modelof peanuthypersensitivity. ClinImmunol 2001;101(2):220–8.
[10] Vial T, Descotes J. Immune-mediated side-effects of cytokines in humans.Toxicology 1995;105(1):31–57.
[11] Cummins JM, Krakowka GS, Thompson CG. Systemiceffect of interferonsafteroraladministration in animals and humans. Am J Vet Res 2005;66(1):164–76.
[12] Brod SA, Khan M. Oraladministration of IFN-alphaissuperior to subcutaneousadministration of IFN-alpha in the suppression of chronicrelapsingexperimentalautoimmune encephalomyelitis. J Autoimmun 1996;9(1):11–20.
[13] Avvakumov EG, Chizhevskaya SV, Stoyanov ES, Povetkina MV, Chekmarev AM,Shafirov VL, et al. Influence of the nature of components in mechanicallyactivatedmixture of zirconium and siliconoxides on solid-phasesynthesis ofzircon. Russ J ApplChemfl 1999;72(9):1498–503.
[14] Zec S, Boskovic S. Ceriumsilicatesformation from mechanicallyactivatedoxidemixtures. J Mater Sci 2004;39:5283–6.
[15] Nakanishi A, Morita S, Iwashita H, Sagiya Y, Ashida Y, Shirafuji H, et al. Role ofgob-5 in mucusoverproduction and airwayhyperresponsiveness in asthma.ProcNatlAcad Sci U S A 2001;98(9):5175–80.
[16] Crosby JR, Guha M, Tung D, Miller DA, Bender B, Condon TP, et al. Inhaled CD86antisenseoligonucleotidesuppressespulmonaryinflammation and airwayhyper-responsiveness in allergic mice. J PharmacolExpTher 2007;321(3):938–46.
[17] Edwan JH, Perry G, Talmadge JE, Agrawal DK. Flt-3 ligandreverses late allergicresponse and airwayhyper-responsiveness in a mouse model of allergicinflammation. J Immunol 2004;172(8):5016–23.
[18] Wiley RE, Cwiartka M, Alvarez D, Mackenzie DC, Johnson JR, Goncharova S,et al. Transientcorticosteroid treatment permanentlyamplifies the Th2response in a murine model of asthma. J Immunol 2004;172(8):4995–5005.
[19] Manetti R, Parronchi P, Giudizi MG, Piccinni MP, Maggi E, Trinchieri G, et al.Natural killer cellstimulatoryfactor (interleukin 12 [IL-12]) induces T helpertype 1 (Th1)-specific immune responses and inhibits the development of IL-4-producingThcells. J ExpMed 1993;177:1199–204
[20] Jagels MA, Daffern PJ, Zuraw BL, Hugli TE. Mechanisms and regulationofpolymorphonuclearleukocyte and eosinophiladherence to human airwayepithelialcells. Am J Respir Cell MolBiol 1999;21(3):418–27.
[21] Monteleone G, Trapasso F, Parrello T, Biancone L, Stella A, Iuliano R, et al.Bioactive IL-18 expressionis up-regulated in Crohn’sdisease. J Immunol1999;163(1):143–7.
[22] Rollwagen FM, Baqar S. Oralcytokineadministration. ImmunolToday1996;17(12):548–50.
[23] Mosmann TR, Sad S. The expandinguniverse of T-cellsubsets: Th1, Th2 andmore. ImmunolToday 1996;17(3):138–46.
[24] Abbas AK, Murphy KM, Sher A. Functionaldiversity of helper T lymphocytes.Nature 1996;383(6603):787–93
[25] Trinchieri G. Interleukin-12: a proinflammatorycytokine with immunoregulatoryfunctionsthat bridge innate resistance and antigen-specificadaptiveimmunity.AnnuRevImmunol 1995;13:251–76.
[26] Paul WE, Seder RA. Lymphocyteresponses and cytokines. Cell1994;76(2):241–51.
[27] Hsieh CS, Macatonia SE, Tripp CS, Wolf SF, O’Garra A, Murphy KM. Developmentof TH1 CD4fl T cellsthrough IL-12 produced by Listeria-inducedmacrophages. Science 1993;260(5107):547–9.
[28] Nabors GS, Afonso LC, Farrell JP, Scott P. Switch from a type 2 to a type 1 Thelpercellresponse and cure of established Leishmania major infection inmice isinduced by combinedtherapy with interleukin 12 and Pentostam. ProcNatlAcad Sci U S A 1995;92(8):3142–6.
[29] Sypek JP, Chung CL, Mayor SE, Subramanyam JM, Goldman SJ, Sieburth DS,et al. Resolution of cutaneousleishmaniasis: interleukin 12 initiates a protectiveT helpertype 1 immune response. J ExpMed 1993;177(6):1797–802.
[30] Wynn TA, Cheever AW, Jankovic D, Poindexter RW, Caspar P, Lewis FA, et al. AnIL-12-based vaccinationmethod for preventingfibrosisinduced by schistosomeinfection. Nature 1995;376(6541):594–6
[31] Chan SH, Perussia B, Gupta JW, Kobayashi M, Pospı´sil M, Young HA, et al.Induction of interferon gamma production by natural killer cellstimulatoryfactor: characterization of the respondercells and synergy with otherinducers.J ExpMed 1991;173(4):869–79.
[32] Seder RA, Gazzinelli R, Sher A, Paul WE. Interleukin 12 actsdirectly on CD4fl Tcells to enhancepriming for interferon gamma production and diminishesinterleukin 4 inhibition of suchpriming. ProcNatlAcad Sci U S A 1993;90(21):10188–92.
[33] Wynn TA, Eltoum I, Oswald IP, Cheever AW, Sher A. Endogenousinterleukin 12(IL-12) regulates granuloma formationinduced by eggs of Schistosoma mansoniand exogenous IL-12 bothinhibits and prophylacticallyimmunizesagainsteggpathology. J ExpMed 1994;179(5):1551–61.
[34] Stevenson MM, Tam MF, Wolf SF, Sher A. IL-12-induced protectionagainstblood-stage Plasmodiumchabaudi AS requires IFN-gamma and TNF-alphaandoccurs via a nitricoxide-dependentmechanism. J Immunol 1995;155(5):2545–56.
[35] Zhou P, Sieve MC, Bennett J, Kwon-Chung KJ, Tewari RP, Gazzinelli RT, et al. IL-12 preventsmortality in mice infected with Histoplasmacapsulatumthroughinduction of IFN-gamma. J Immunol 1995;155(2):785–95.
[36] Wynn TA, Jankovic D, Hieny S, Zioncheck K, Jardieu P, Cheever AW, et al. IL-12exacerbatesratherthansuppresses T helper 2-dependent pathology in theabsence of endogenous IFN-gamma. J Immunol 1995;154(8):3999–4009.
[37] Ma X, Chow JM, Gri G, Carra G, Gerosa F, Wolf SF, et al. The interleukin 12 p40gene promoter isprimed by interferon gamma in monocyticcells. J Exp Med1996;183(1):147–57.
[38] Murphy KM, Ouyang W, Farrar JD, Yang J, Ranganath S, Asnagli H, et al.Signaling and transcription in T helperdevelopment. AnnuRev Immunol2000;18:451–94.
[39] Li XM, Chopra RK, Chou TY, Schofield BH, Wills-Karp M, Huang SK. MucosalIFN-gamma gene transfer inhibitspulmonaryallergicresponses in mice. JImmunol 1996;157(8):3216–9.
[40] Lack G, Bradley KL, Hamelmann E, Renz H, Loader J, Leung DY, et al. NebulizedIFN-gamma inhibits the development of secondaryallergicresponses in mice.JImmunol 1996;157(4):1432–9.
[41] Benjaponpitak S, Oro A, Maguire P, Marinkovich V, DeKruyff RH, Umetsu DT. Thekinetics of change in cytokine production by CD4 T cellsduringconventionalallergenimmunotherapy. J AllergyClinImmunol 1999;103(3 Pt 1):468–75.
[42] Tompkins WA. Immunomodulation and therapeuticeffects of the oral use of interferon-alpha: mechanism of action. J Interferon Cytokine Res1999;19(8):817–28.
[43] Moore BR, Krakowka S, Cummins JM, Robertson JT. Changes in airwayinflammatorycellpopulations in standardbredracehorsesafterinterferonalphaadministration. VetImmunolImmunopathol 1996;49(4):347–58.
[44] Romagnani S. Regulation of the T cellresponse. ClinExp Allergy2006;36(11):1357–66.
[45] Okazawa A, Kanai T, Watanabe M, Yamazaki M, Inoue N, Ikeda M, et al. Th1-mediatedintestinalinflammation in Crohn’sdiseasemay be induced byactivation of lamina propria lymphocytesthroughsynergisticstimulation ofinterleukin-12 and interleukin-18 without T cellreceptor engagement. Am JGastroenterol 2002;97(12):3108–17.
[46] S. Gariboldi et al. / PulmonaryPharmacology&Therapeutics 22 (2009) 497–510 509
Giovanni Francesco Di Paolo M.D. “Research Institute in Anti Aging Medicine"