“La Microchirurgia dei Linfatici Nella Formazione e Nella 'Best-Practice'
in Chirurgia”
Corradino Campisi
Presidente della Società Italiana di
Linfangiologia (SIL) e del Latin-Mediterranean Chapter of the International
Society of Lymphology (LMC-ISL)
Presidente della Società Ligure di
Chirurgia (SLC)
Professore Ordinario di Chirurgia
Generale, Coordinatore della Scuola di Specializzazione in Chirurgia
dell’Apparato Digerente (Sede di Genova, Confederata con Pisa, Firenze e Siena)
Direttore della Unità Operativa di
Chirurgia dei Linfatici
Dipartimento Universitario di Scienze
Chirurgiche e Diagnostiche Integrate (DISC)
Sezione Scientifica di Linfologia e
Microchirurgia applicate in Chirurgia Generale
Centro di Ricerca di Chirurgia dei
Linfatici, Linfologia e Microchirurgia
Dipartimento Assistenziale Integrato
di Chirurgia Generale, Specialistica ed Oncologica
IRCCS – Azienda Ospedaliera
Universitaria San Martino – IST
Istituto Nazionale per la Ricerca sul
Cancro
Genova
Introduzione
I recenti progressi in
microchirurgia, il perfezionamento dell’imaging non-invasivo e dinamico
del sistema linfatico, unitamente a migliori approcci all’exeresi chirurgica
hanno tutti beneficiato dei contributi pionieristici di linfologi chirurghi,
facendo sì che la microchirurgia linfatica e la chirurgia delle patologie
linfatiche diventassero un’opzione concreta e sicura nella cura di queste
patologie sia congenite che acquisite, croniche, fastidiose, deturpanti,
disabilitanti, a volte persino pericolose per la vita. Tra i progressi
realizzabili in futuro, in termini sia di campo di intervento che di risultati
di queste procedure, si annoverano interventi chirurgici mini-invasivi e
robotizzati, abbinati eventualmente anche all’ingegneria tissutale , alle
cellule staminali e ai trapianti di tessuti. Per tutti questi progressi, e, in
ultimo, per arrivare ad interventi riparativi già a livello fetale, con
l’obiettivo di prevenire o curare queste patologie linfatiche, c’è bisogno
dell’intelligenza e delle competenze del chirurgo come membro attivo dei team di
ricerca e di gestione multimodale degli aspetti clinici.
EVOLUZIONE DELLA MICROCHIRURGIA
LINFATICA
I primi ad utilizzare la
microchirurgia furono Cockett1 e Goodwin nel 1962, per il
trattamento di un paziente affetto da chiluria, realizzando un’anastomosi tra un
linfatico lombare dilatato e la vena spermatica. Dopo questo primo intervento,
grazie al successivo sviluppo delle tecniche microchirurgiche (descritte qui di
seguito), l’anastomosi linfatico-venosa è diventata un’opzione concreta nella
cura del linfedema.
O'Brien e coll.2,3 nel
1977 descrissero l’impiego della microchirurgia linfatica nel trattamento del
linfedema ostruttivo secondario, che prevedeva tre o più anastomosi
linfatico-venose praticate all’altezza del gomito o del ginocchio, o sopra di
esso, a seguito del quale gli autori osservarono una minore incidenza
post-operatoria di cellulite. Questa tecnica di microchirurgia linfatica, che,
secondo questi autori, richiedeva una considerevole esperienza in chirurgia
microvascolare, era adatta sia per gli arti superiori che per quelli inferiori e
fu anche praticata in pazienti con linfedema ostruttivo causato da trauma o da
condizioni di costrizione congenita. Ulteriori avanzamenti in questo campo si
ebbero quando, nel 1981, Degni4,5 introdusse una tecnica originale di
anastomosi linfatico-venosa per il linfedema degli arti, con l’obiettivo, in
caso di vasi linfatici ostruiti, di deviare la linfa in una vena, specialmente
quando alla linfografia i vasi linfatici risultavano essere ancora ben
funzionanti e senza problemi di permeabilità.
Quasi contemporaneamente (1982),
Clodius6,7 riferiva che la microchirurgia nel trattamento del
linfedema primario e secondario, consistente nella realizzazione di derivazioni
tra i vasi linfatici e le vene, fosse già una tecnica chirurgica ben
consolidata, benché incontrasse svariati problemi causati dalle modificazioni
irreversibili del sistema linfatico e del tessuto connettivo e dalla distruzione
dei linfatici profondi, condizioni che, tipiche dei pazienti con linfedema
cronico, avrebbero potuto maggiormente beneficiare delle anastomosi
linfatico-venose. Per queste ragioni Clodius raccomandava l’uso dei shunt
linfatico-venosi in fase precoce della malattia, prima della comparsa di
modificazioni fibrotiche.
Una revisione critica delle
anastomosi linfo-venose con tecniche microchirurgiche per il trattamento del
linfedema fu pubblicata da Gloviczki e coll. 8 nel 1988, gruppo che
praticava le anastomosi linfo-venose (LVA) per il trattamento del linfedema
cronico con un follow-up medio di 36,6 mesi. Gli Autori concludevano il lavoro
dicendo che l’LVA rappresentava un trattamento fisiologico promettente,
particolarmente in pazienti con linfedema secondario e che la linfoscintigrafia
era una metodologia adatta sia per l’individuazione, prima dell’intervento, dei
canali linfatici pervi, sia per la valutazione del buon funzionamento dell’LVA
post-intervento.
Nonostante i progressi in
microchirurgia, non era ancora chiaro quale potesse essere la tecnica chirurgica
più adatta al trattamento del linfedema primario.
Materiale e Metodi
MICROCHIRURGIA LINFATICA E APPROCCI
CHIRURGICI AL LINFEDEMA: ASPETTI CLINICI E TECNICI
Tecniche Derivative
I primi interventi di microchirugia
derivativa consistevano nella realizzazione di derivazioni linfonodo-venose, in
gran parte non più praticate (ad eccezione di zone come l’India, dove la
filariasi linfatica è endemica), per via dell’alto tasso di deiscenza
anastomotica provocata dall’effetto trombogenico della polpa linfonodale sul
sangue venoso e dalla frequente riendotelizzazione della superficie del
linfonodo.
Proprio per le difficoltà incontrate
dai chirurghi in tutto il mondo con gli shunt linfonodo-venosi, si
procedette successivamente con l’anastomizzazione dei vasi linfatici alle vene.
Le prime operazioni di questo tipo condotte all’Università di Genova usavano la
tecnica termino-laterale (linfa- sangue)9, con la quale venivano
inseriti nella vena i collettori linfatici, per cui il bordo inferiore del vaso
linfatico inserito nel lume della vena funziona da valvola per evitare che il
sangue possa rifluire nel vaso linfatico e quindi provocare la trombosi. Secondo
la tecnica preferita più recente, di tipo telescopico, e consistente in
anastomosi linfatico-venose multiple, i vasi linfatici risultati sani
all’osservazione nella sede dell’intervento vengono tutti inseriti direttamente
nella vena con un punto a U e quindi fissati all’estremità tagliata della vena
con altre suture tra il bordo della vena e il tessuto adiposo peri- linfatico
(Figura 1). Alla fine, viene levato il primo punto a U per evitare la chiusura
dei collettori linfatici. Utilizzando il colorante vitale Blue Patent Violet (un
sale monosodico di metanolo) è possibile individuare i linfatici ancora
funzionanti, i quali si colorano di blu. Con l’ingresso della linfa colorata di
blu nel ramo venoso, una volta portata a termine l’anastomosi linfatico-venosa,
ne si può verificare la pervietà al microscopio operatorio (Figura 2)
Per il trattamento del linfedema
degli arti inferiori vengono preparate anastomosi linfatico-venose multiple (MLVA)
nella sede di un’unica incisione nella regione sotto-inguinale (Figura 4),
mentre per il linfedema degli arti superiori si realizzano le MLVA nel terzo
medio superiore della superficie volare del braccio, utilizzando i collettori
linfatici afferenti sia superficiali che profondi, visualizzati con il BPV
(Figura 3). I vasi linfatici profondi vengono localizzati tra l’arteria
brachiale, la vena e il nervo mediale. Per l’anastomosi, con l’impiego della
tecnica telescopica, viene utilizzato un ramo pervio di una delle vene brachiali
dotata di valvola funzionante.
Tecniche Ricostruttive
Nei casi di linfedema degli arti
inferiori, se presente patologia venosa non trattabile chirurgicamente, è
sconsigliato l’uso di tecniche linfatico-venose derivative, per cui vengono
impiegati i metodi ricostruttivi 10-12 . La tecnica più comunemente
utilizzata è l’interposizione di un innesto di vena autologa tra i vasi
linfatici a monte e a valle dell’ostacolo che blocca il flusso linfatico (Figura
1). E’ possibile ottenere il segmento di vena dalla stessa sede oppure
dall’avambraccio (nella maggioranza dei casi, la vena cefalica). La lunghezza
dell’innesto varia dai 7 ai 15 cm. E’ inoltre importante inserire alcuni vasi
linfatici all’estremità distale del segmento di vena reciso in modo che,
riempito di linfa, non si possa chiudere a seguito di processi fibrotici. Le
valvole della vena servono per mantenere la giusta direzione del flusso
linfatico e per evitare il reflusso gravitazionale. La tecnica di anastomosi è
di tipo telescopico, con l’inserimento dei vasi linfatici all’interno
dell’estremità recisa della vena, fermati con un punto a U e quindi fissati con
alcuni punti periferici.
Gli interventi di debulking
praticati in passato sono ora meno utilizzati per trattare il linfedema, salvo
nei casi di linfedema di stadio più avanzato per ridurre l’eccesso di pieghe, in
modo particolare in quelle regioni del corpo (ad es. i genitali) non accessibili
a trattamenti fisici compressivi efficaci cutanee, dopo una significativa
riduzione dell’edema ottenuto con metodi medico-fisici conservativi e
microchirurgici. Il debulking viene ancora praticato in casi di filariasi
avanzata, a volte abbinato ad anastomosi linfatico-venosa o linfonodale-venosa,
in presenza di canali linfatici fortemente dilatati 13, o in casi di
lipolinfedema localizzato associato a grave obesità e immobilità forzata.
Negli ultimi anni le tecniche di
liposuzione si sono affinate per potere essere impiegate nel trattamento delle
patologie linfatiche. Nei pazienti affetti da linfedema di stadio avanzato,
ovvero proprio quelli per i quali viene prescritta la liposuzione, i vasi e
canali linfatici sono spesso dilatati e tortuosi 14, il che a sua
volta rende più difficile utilizzare la cannula da liposuzione senza causare
danni a questi vasi molto più vulnerabili. Abbiamo recentemente messo a punto
una nuova tecnica di linfo-lipo-aspirazione (Fibro-Lipo-Linfo-Aspirazione (FLLA)
con Lymph Vessel Sparing Procedure (LVSP), Corrado Cesare Campisi), atta a
ridurre lo stato di edema cronico dei pazienti con linfedema di stadio avanzato,
seguendo un approccio lymphatic-sparing, ovvero di risparmio dei vasi
linfatici. Il tessuto adiposo in eccesso può essere accuratamente aspirato,
grazie all’impiego del Blue Patent Violet (BPV) unito a fluorescenza al verde di
indocianina (ICG ) con il sistema Photodynamic Eye (PDE), per visualizzare le
vie linfatiche dell’arto (Figura 6).
Abbiamo anche introdotto un approccio
di prevenzione primaria utilizzando l’LVA e l’ LVLA nello stesso tempo
operatorio della linfoadenectomia per il trattamento chirurgico del cancro (il
cosiddetto Lymphatic Microsurgical Preventive Healing Approach – Ly.M.P.H.A
15-17), un approccio inizialmente applicato in un trial controllato
randomizzato di pazienti sottoposte a exeresi linfonodale per il trattamento del
cancro della mammella, in tutti quei casi in cui, dagli esami pre-intervento,
risultava un maggiore rischio di insorgenza del linfedema. Nelle pazienti
sottoposte all’approccio Ly.M.P.H.A, si è registrato solo un edema transitorio
nel 4,34% dei casi, mentre nel gruppo di pazienti sottoposte al trattamento
standard, il 30,43% di queste ha sviluppato un linfedema permanente. Abbiamo
anche applicato questa promettente tecnica preventiva, con eccellenti risultati
18, in casi di melanoma e carcinoma vulvare, con interessamento dei
linfonodi ascellari/inguinali-crurali-iliaci-otturatori.
SINDROMI LINFANGIODISPLASICHE E
REFLUSSO CHILOSO E NON CHILOSO
Le patologie da reflusso, ovvero un
anomalo flusso retrogrado della linfa, possono generarsi al di fuori
dell’intestino (nel qual caso si parla di reflusso non-chiloso) o all’interno
dell’intestino (quindi reflusso chiloso, di aspetto lattescente).
Poiché il colesterolo e i
trigliceridi a catena lunga contenuti nel chilo possono essere assorbiti solo
attraverso il sistema linfatico, qualsiasi alterazione, compressione, ostruzione
o fistolizzazione dei vasi chiliferi, della cisterna chili e del dotto toracico
possono portare a chilotorace, asciti chilose, chiluria e a reflusso chiloso in
altri comparti. In alcuni pazienti con grave ostruzione del flusso della linfa
intestinale si ha una graduale dilatazione dei linfatici periferici, con perdita
di competenza valvolare e reflusso di linfa lattescente nei tessuti molli della
pelvi, dello scroto e degli arti inferiori (vescicole chilose), manifestandosi
anche, ad esempio nei neonati, sottoforma di chiledema sottocutaneo
generalizzato.
Approcci Terapeutici
Per potere rapidamente ripristinare
un corretto equilibrio metabolico, si consiglia di iniziare subito una
Nutrizione Parenterale Totale (NPT) mirante a ridurre il volume di raccolta
chilosa. Nell’approccio iniziale a questa patologia complessa, specialmente nei
casi con insorgenza acuta o sub-acuta, è utile sottoporre il paziente a
video-laparoscopia, che può anche risultare utile per il corretto posizionamento
di uno o più drenaggi peritoneali di calibro appropriato, che, una volta
inseriti, possono servire per un uso “a richiesta”, ad esempio in caso di
lavaggi con soluzione sterile di Trémolliéres (acido lattico concentrato)
abbinata ad un antibiotico (250-500 mg di rifamicina sodica). L’effetto
sclerosante di questo farmaco ha dimostrato la propria utilità, in particolare
nel trattamento del chiloperitoneo post-operatorio.
Il chiloperitoneo primario causato da
displasia o malformazioni rappresenta una condizione molto più complessa e
richiede una valutazione diagnostica accurata per l’impostazione di una terapia
corretta, a seconda delle caratteristiche cliniche associate a questa
condizione, ovvero:
• test 51CrCl3
per l’individuazione di eventuali grosse perdite di proteina addominale (>2% di
eliminazione fecale del radioisotopo entro 5 giorni dalla somministrazione della
sostanza per via endovenosa).
•Clisma opaco dell’intestino tenue,
per l’individuazione di eventuali ispessimenti dovuti al linfedema, generalmente
maggiori a livello della sottomucosa della parete intestinale con conseguente
protrusione delle pliche e dei villi intestinali;
•Endoscopia dell’intestino tenue, in
particolare con biopsia del segmento duodeno-digiuno, che si presenta, al centro
dei villi, con vasi chiliferi molto allungati;
•Linfoscintigrafia, per potere
evidenziare non solo una perdita di tracciante nella cavità peritoneale, ma
anche un’eventuale displasia, più o meno grave, che può interessare anche altri
comparti, quali i genitali esterni e gli arti inferiori.
• Linfangiografia standard con mezzo
di contrasto liposolubile ultrafluido iniettato con tecnica microchirurgica dopo
isolamento e incannulamento dei vasi linfatici del muscolo estensore lungo delle
dita. Se abbinata a TAC, la linfangiografia permette una valutazione più
accurata dell’estensione della malattia, oltre all’individuazione del sito
dell’ostruzione e della fonte di fuoriuscita di chilo;
•Risonanza magnetica che, con tecnica
di sottrazione digitale dei tessuti adiposi, offre una dimostrazione più
dettagliata dei vasi linfatici affetti da alterazioni displasiche (Linfangio-RM)
Trattamento Chirurgico
A questo punto l’intervento
chirurgico dipende dall’esito dei vari trattamenti conservativi già in atto,
cioè: dieta iperproteica e ipolipidica (ovvero con apporto lipidico limitato
esclusivamente ai grassi a base di “Trigliceridi a Catena Media”) e Nutrizione
Parenterale Totale (NPT); adeguata protezione antibiotica, necessaria per
prevenire e trattare le non rare complicanze settiche, oltre anche a paracentesi
seriale mirata al drenaggio graduale della raccolta chilosa per diminuire la
pressione intra-addominale.
Pertanto, il trattamento chirurgico,
da studiarsi caso per caso a seconda della natura primaria o secondaria del
riversamento chiloso, della rilevanza clinica e del numero di spandimenti
chilosi, può comprendere: l’individuazione della o delle sedi della
chilo-linforrea e del chilo-peritoneo, il posizionamento di drenaggi per ridurre
il chilotorace, la pleurodesi toracoscopica e decorticazione pleurica; legatura,
cucitura, o chiusura con clip chirurgiche, a seconda del caso, dei vasi
linfatici , eliminazione del linfocele, asportazione di cisti chilose e/o
chilomi; exeresi di eventuale tessuto linfangectasico-linfangiodisplasico; le
legature “scaglionate” antigravitazionali dei collettori linfatici chiliferi;
l’uso della tecnica LASER CO2 che, se applicata a bassa potenza, ha un effetto
welding, ovvero di saldatura, sia sui linfatici che su molti altri
tessuti e vasi sanguigni con diametro fino a 1 mm. Molto utile per un migliore
riconoscimento dei collettori chiliferi risulta la somministrazione di un “pasto
grasso” secondo Servelle (60 grammi di burro in una tazza di latte) assunto dal
paziente 4-5 ore prima dell’intervento. L’approccio videolaparoscopico a
supporto di quello laparotomico, spesso in associazione alle procedure
microchirurgiche LASER-assistite, rappresenta la condotta terapeutica oggi più
accreditata dal maggior numero di successi. Nei casi più ribelli di chilotorace,
può essere necessario uno shunt pleuro-venoso/pleuro-peritoneale, con
l’obiettivo di offrire al chilo una nuova strada di efflusso, il che
spiegherebbe la riduzione di pressione a lungo termine all’interno del sistema
linfatico e della cavità peritoneale. Oltre alle sopra citate procedure, anche
l’anastomosi linfatico-venosa derivativa o le anastomosi
linfatico-venose-linfatiche con tecnica microchirurgia ricostruttiva, se
tecnicamente fattibili, possono essere assai efficaci, poiché offrono una
riparazione funzionale, su misura, dei riversamenti linfochilosi, con il
ripristino delle vie linfatiche esistenti e la creazione di nuove vie in
prossimità di quelle naturali. 19-23
Casistica e Risultati
La nosta casistica conta diverse
migliaia di casi, avendo iniziato nel 1973. Per dovere di sintesi, non ci è
possibile scendere nei dettagli, ma ci riferiremo, una per tutte, a quella dei
linfedemi, che assume valore paradigmatico ( Figura 7). I risultati a lungo
termine (da almeno 5 ad oltre 20 anni dopo l’intervento di microchirurgia) sono,
soprattutto, significativi negli stadi più precoci, potendo raggiungere anche la
guarigione o, comunque, garantendo un sensibile miglioramento della qualità di
vita, negli stadi più avanzati (Figura 8).
Discussione
LE FRONTIERE DELLA CHIRURGIA
LINFATICA
Con il continuo sviluppo delle
conoscenze dei linfedemi periferici, sia primari che secondari, questo tipo di
patologia sta diventando sempre più facile da gestire, grazie anche ad una
maggiore sensibilizzazione e individuazione precoce. Mentre i trattamenti non
chirurgici, che mirano a ridurre la morbilità, non riescono a eliminare la causa
sottostante della patologia, la microchirurgia derivativa e ricostruttiva, che,
se abbinata ai metodi di riabilitazione fisica, ottiene i risultati migliori, è
in grado di ripristinare il drenaggio linfatico, sia a breve che a lungo
termine.
Ci si dovrebbe concentrare
maggiormente sulla prevenzione del linfedema secondario degli arti attraverso la
comprensione dell’eziologia multifattoriale della patologia, ad esempio dei
fattori che distinguono le donne a maggior rischio di insorgenza del linfedema
post-mastectomia. Modificando la gestione chirurgica della regione ascellare (o,
in futuro, di quella inguinale e retroperitoneale) delle pazienti oncologiche
per le quali è prevista la resezione o il campionamento dei linfonodi, senza
comunque fare nessun compromesso sui principi di cura oncologica, si potrebbe
avere un effetto positivo sulla riduzione delle complicanze linfatiche di queste
procedure.
La chirurgia esiste per l’ignoranza
della medicina nel ritenere di poter fare a meno della chirurgia. Con l’impiego
di correlazioni fenotipo-genotipo, si potrebbero identificare quelle
predisposizioni genetiche allo sviluppo del linfedema secondario post-chirurgico
(ad esempio difetti genetici nei fattori di crescita/ recettori
linfatico-specifici). Nelle famiglie con linfedema primario, nelle quali si sono
individuati mutazioni o linkage genetici, attraverso dei test dei familiari più
giovani ancora non affetti dalla patologia, si potrebbe fare una diagnosi
precoce e una gestione preventiva dei linfedemi congeniti. La chirurgia
terapeutica profilattica e personalizzata potrebbe basarsi sul genotipo
individuale o tumorale, aprendo così la strada ad una “chirurgenomica” analoga
alla chirurgia preventiva nei tumori endocrini con base eredo-familiare. Anche
la terapia genetica, che ha l’obiettivo di stimolare la crescita di nuovi
linfatici o migliorare le funzionalità linfatiche degli arti affetti,
rappresenta un’altra possibilità per il futuro.
Conclusione
Per concludere, con il progresso
della Medicina, oltre ad un migliore controllo dei tumori primari ed invasivi e
delle infezioni/infestazioni quali, nel panorama mondiale, quelle causate dalla
filariasi, che rappresentano la stragrande maggioranza dei linfedemi acquisiti,
dovrebbero emergere delle opportunità nuove e preventive per la gestione
non-chirurgica del linfedema e delle altre patologie linfatiche. Fino ad allora,
con molta probabilità, la chirurgia e i chirurghi, guidati da sistemi sempre più
efficaci di imaging molecolare e multimodale del sistema linfatico,
svolgeranno un ruolo sempre più importante non solo nella ricerca, prevenzione e
gestione (e, perché no, nelle potenziali "cure" delle patologie linfatiche sia
primarie che secondarie), ma anche nella correzione, exeresi e/o eliminazione
delle principali malformazioni e tumori che interessano il sistema linfatico.
|

Figura 1.
Un disegno schematico della tecnica
derivata MLVA e
la tecnica ricostruttiva
MLVLA con l'interposizione
del un
innesto venoso autologo
tra linfatici
sopra e sotto l'ostacolo
al flusso della linfa
(Campisi, 1982)
|
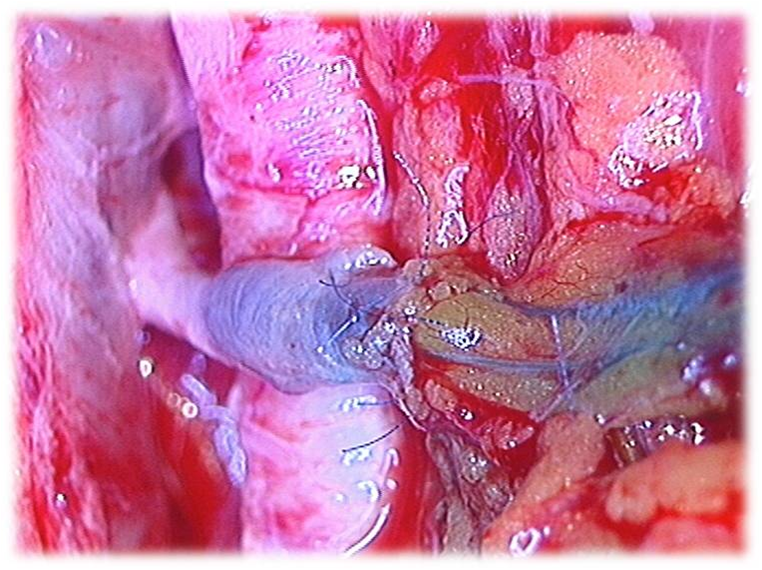
Figura
2. MLVA:
Il passaggio della linfa
colorata di BPV nel ramo
vena, come
evidente sotto il
microscopio operatorio,
verifica la pervietà
dell'anastomosi |
|
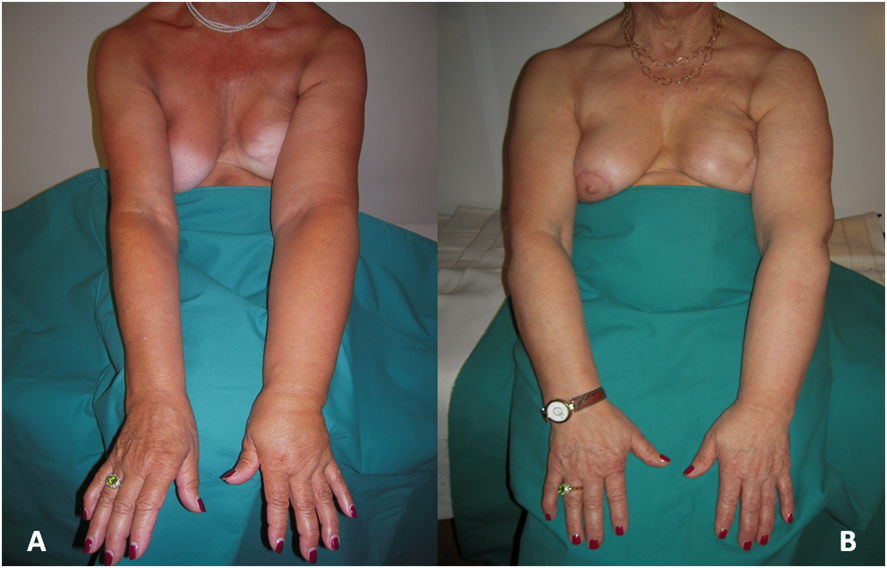
Figura 3. (A) Foto
pre-operatoria di paziente con linfedema post-mastectomia dell'arto
superiore sinistro (stadio IIA-IIB). Controllo a 5 anni dopo
l’intervento (B) . |

Figura 4. Linfedema dell’arto
inferiore sinistro (A: quadro pre-operatorio), con risultato a
medio-lungo termine, significativamente evidenziato anche dalla
pressocchè totale scomparsa del colorante vitale dalla sede di iniezione
alla coscia (B) |
|
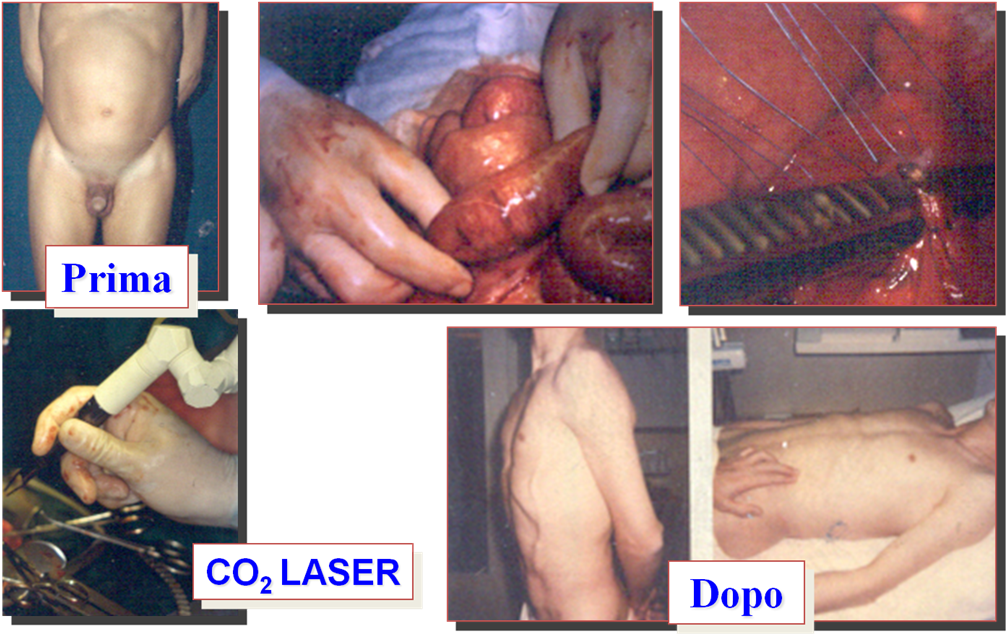
Figura 5. Microchirurgia e
Tecniche Complimentari (LASER) nel trattamento di vari quadri di
patologia dei vasi chiliferi (Chiloperitoneo e Peritonite Chilosa)
|

Figura 6. Foto
pre-operatoria di paziente con linfedema dell’arto inferiore (A), già
trattata vantaggiosamente con MLVA. (B) Dopo l’intervento di FLLA
|
|
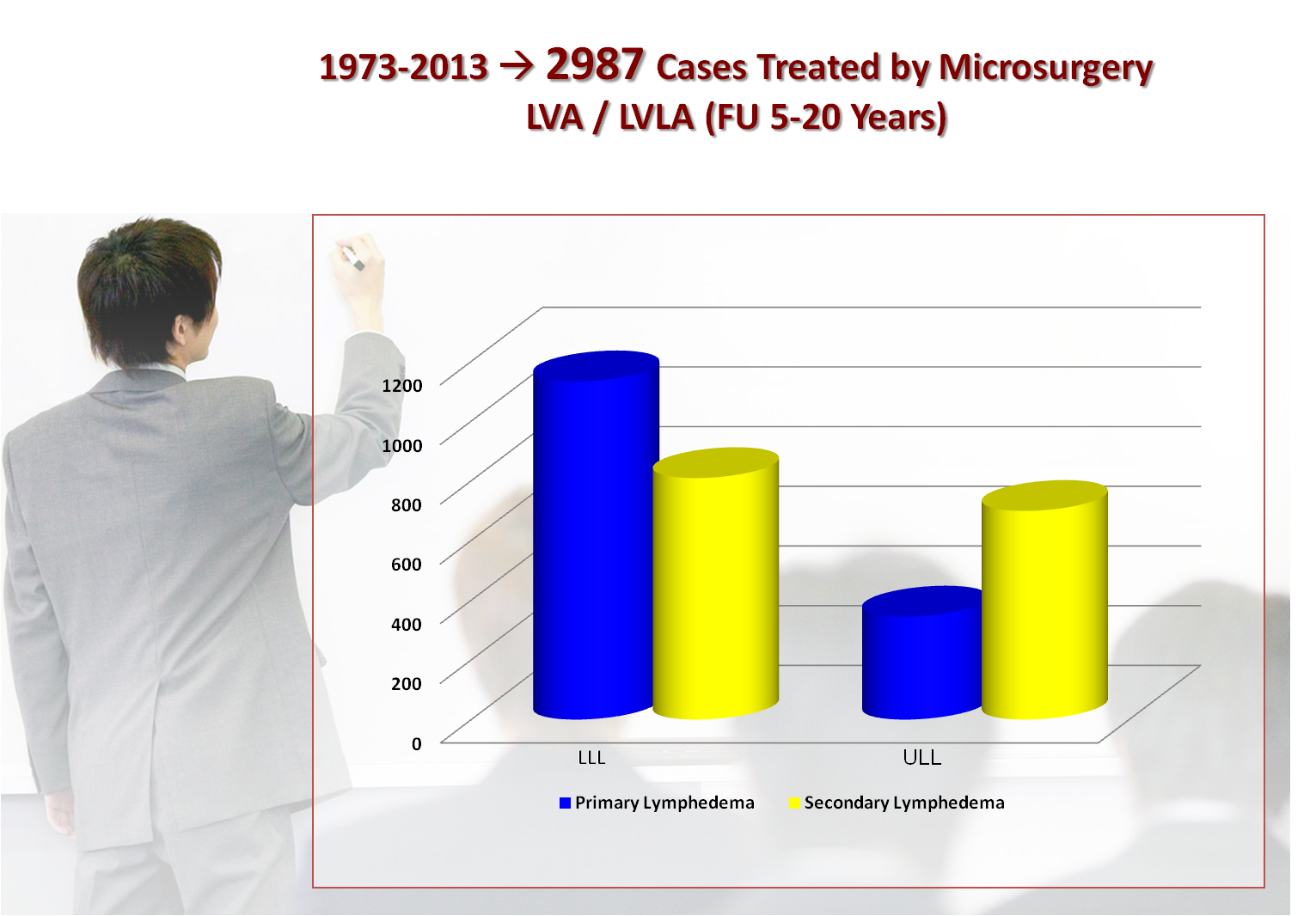
Figura 7. Casistica dei
Linfedemi trattati con Microchirurgia |
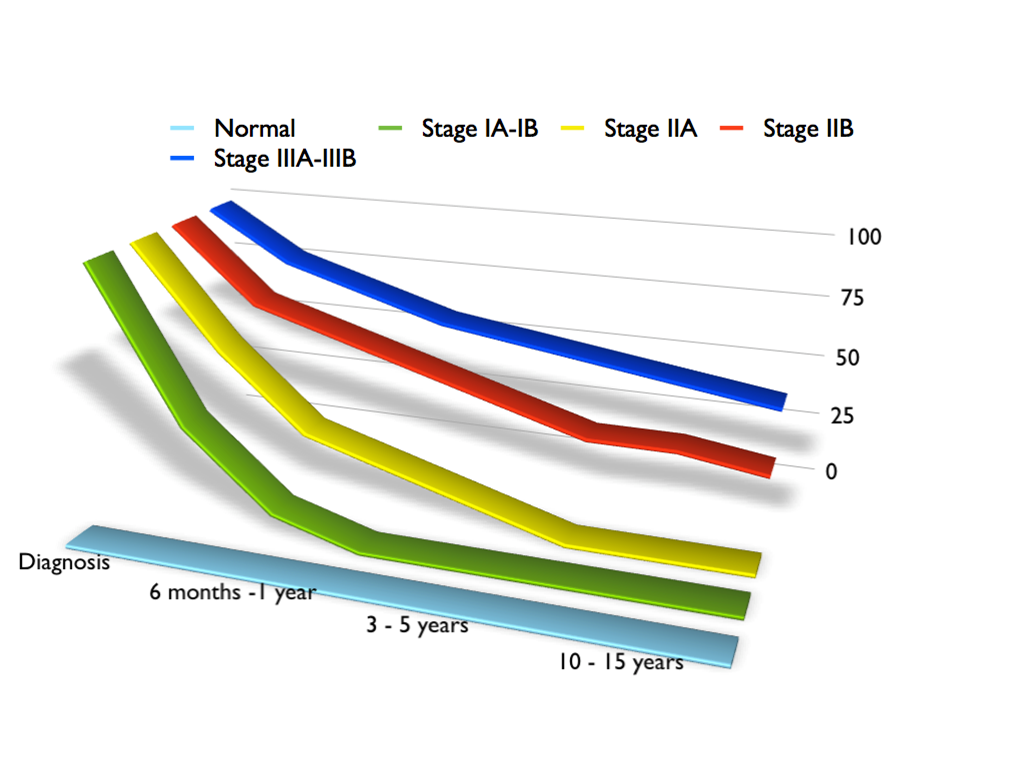
Figura 8. Risultati a lungo
termine |
BIBLIOGRAFIA
1
Cockett, ATK, and Goodwin, WE: Chyluria: Attempted surgical treatment by
lymphatic venous anastomosis. J. Urol. 88:566, 1962
2
O'Brien, BM, Sykes, P, and Threlfall GN, et al: Microlymphaticovenous
anastomoses for obstructive lymphedema. Plast. Reconstr. Surg. 60:197, 1977
3
O'Brien, B: Microlymphatic-venous and resectional surgery in obstructive
lymphoedemas. World J. Surg. 3, 3, 1979
4
Degni, M: New microsurgical technique of lymphatic-venous anastomosis for the
treatment of lymphedema. Lymphology 14:61, 1981
5
Degni, M: New techniques of lymphatic-venous anastomosis for the treatment of
lymphoedema. Cardiovasc. Rivista Brasileira 10:175, 1974
6
Clodius, L, Piller, NB, and Casley-Smith, JR: The problems of lymphatic
microsurgery for lymphoedema. Lymphology 14:69, 1981
7
Clodius, L: Problems of microsurgery in lymphedema. Handchir. Mikrochir. Plast.
Chir. 14:79, 1982
8
Gloviczki, P, Fisher, J, and Hollier, LH, et al: Microsurgical lymphovenous
anastomosis for the treatment of lymphedema: a critical review. J. Vasc. Surg.
7:647, 1988
9
Campisi, C, and Boccardo, F: Role of microsurgery in the management of
lymphoedema. Int. Angiol. 18:47, 1999.
10
Campisi, C: Use of autologous interposition vein graft in management of
lymphedema. Lymphology 24,71, 1991
11
Campisi, C: Lymphatic microsurgery: A potent weapon in the war on lymphedema.
Lymphology 28:110, 1995
12
Campisi, C, Boccardo, F, and Tacchella, M: Reconstructive microsurgery of lymph
vessels: The personal method of lymphatic-venous-lymphatic (LVL) interpositioned
grafted shunt. Microsurgery 16:161, 1995
13
Jamal S: Lymph nodo-venous shunt in the treatment of protein losing enteropathy
and lymphedema of leg and scrotum. Lymphology 40:47-48, 2007.
14 Lu Q, Delproposto Z, Hu A, Tran C, et Al.
MR lymphography of lymphatic vessels in lower extremity with
gynecologic oncology-related lymphedema. PlosONE 2012;7:e50319
15 Boccardo F, Casabona F, Friedman D, et Al.
Surgical prevenzione of arm lymphedema in breast cancer
treatment. Ann Surg Oncol. 2011;18:2500-2505
16 Boccardo F, Campisi CC, Molinari L, et Al.
Lymphatic complications in surgery: possibility of
prevenzione and therapeutic options. Updates Surg. 2012 Sep.;64(3):211-6. Epub
2012 Jul. 21
17 Campisi CC, Larcher L, Lavagno R, et Al.
Microsurgical primary prevenzione of lymphatic injuries
following breast cancer treatment. Plast Reconstr Surg. 2012 ;130:749e-750e
18 Morotti M, Menada MV, Boccardo F, et Al.
Lymphedema microsurgical preventive healing approach for
primary prevenzione of lower limb lymphedema after inguinofemoral
lymphadenectomy for vulvar cancer. Int J Gynecol Cancer. 2013 May;23(4):769-74.
19
Campisi C, Boccardo F. Microsurgical techniques for lymphedema treatment:
derivative lymphatic-venous microsurgery. World J Surg 2004; 28:609-613.
20 Campisi CC, Larcher L, Lavagno R, et Al.
Microsurgical primary prevenzione of lymphatic injuries
following breast cancer treatment. Plast Reconstr Surg. 2012 ;130:749e-750e
21
Campisi C, Boccardo F, Campisi CC, Ryan M. Reconstructive microsurgery for
lymphedema: while the early bird catches the worm, the late riser still
benefits. J Am Coll Surg. 2013;216:506-7
22
Ryan M, Campisi CC, Boccardo F et al. Surgical treatment for lymphedema: optimal
timing and optimal techniques. J Am Coll Surg. 2013;216:1221-3.
23 Campisi CC, Ryan M, Boccardo
F et al. Ly.M.P.H.A. and the prevenzione of lymphatic injuries: A rationale for
early microsurgical intervention. J Reconstr Microsurg. 2014; 30(01):
071-072.
Professore Ordinario di Chirurgia
Generale, Genova
Direttore della Unità Operativa di
Chirurgia dei Linfatici, Genova
IRCCS – Azienda Ospedaliera
Universitaria San Martino – IST
Istituto Nazionale per la Ricerca sul
Cancro
Genova







