I tumori della tiroide:
nuove acquisizioni diagnostiche, prognostiche e terapeutiche
M. D’Armiento, S. Ulisse
Introduzione
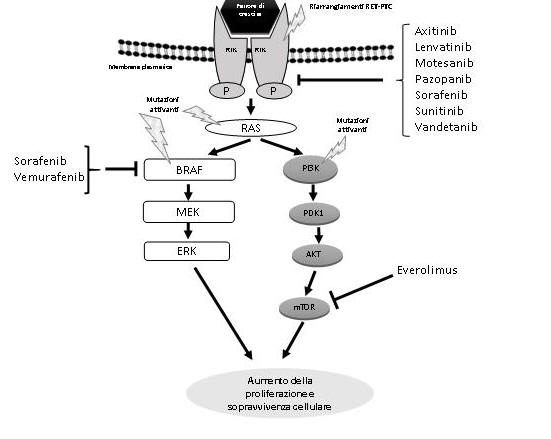
I tumori derivati dal tireocita rappresentano la neoplasia endocrina più frequente e negli Stati Uniti sono il quinto tumore più comune nelle donne (1). I tumori tiroidei includono i due carcinomi differenziati della tiroide (DTC), il carcinoma papillare (PTC) e follicolare (FTC). Da questi, in seguito a de-differenziazione, origina il carcinoma anaplastico della tiroide, un tumore altamente aggressivo ed invariabilmente fatale (1). Sebbene derivati dallo stesso tipo cellulare, i diversi tumori della tiroide mostrano specifiche caratteristiche istologiche, comportamento biologico e grado di differenziazione in conseguenza di diverse alterazioni genetiche (2). In particolare, le principali mutazioni genetiche implicate nella progressioni dei DTC includono i riarrangiamenti genici di recettori tirosin-chinasi (i.e. RET/PTC) e mutazioni attivanti proteine che mediano le risposte cellulari ai segnali di crescita, tra cui RAS e BRAF (figura 1).

I noduli tiroidei sono molto comuni, con un’incidenza compresa tra il 19% e il 67% della popolazione adulta, ma solo il 5% di essi ospita una lesione maligna (1). Pertanto, il primo obiettivo nella valutazione clinica di un nodulo tiroideo è quello di escludere la sua malignità. A tal fine, l’esame citologico eseguito su materiale agoaspirato sotto guida ecografica (FNAC) rappresenta attualmente il principale strumento diagnostico (3, 4). La FNAC è inoltre impiegata per la diagnosi delle metastasi linfonodali da DTC sia in fase preoperatoria che nel corso del follow-up dei pazienti. Tuttavia, tale tecnica risente di limitazioni importanti, di cui si tratterà in seguito, che rendono talvolta necessaria la conferma dell’esame istologico e dunque l’intervento chirurgico.
La tiroidectomia totale seguita da terapia adiuvante con Iodio131 è il trattamento di scelta per la maggior parte dei pazienti affetti DTC (1). Successivamente, il follow-up comprende la scintigrafia 6-12 mesi dopo l'intervento chirurgico, l’ecografia periodica del letto tiroideo e dei compartimenti linfonodali latero-cervicali, e la determinazione dei livelli di tireoglobulina (Tg) sierica in condizioni basali o dopo stimolo con TSH umano ricombinante (1). Anche se la prognosi dei pazienti con DTC è largamente favorevole, con una sopravvivenza a 10 anni di oltre il 90%, circa il 20% di essi sviluppa recidive o va incontro a decesso correlato al tumore. Ad oggi, la prognosi dei pazienti affetti da DTC si basa ancora su variabili clinico-patologiche quali l'età del paziente, la dimensione del tumore e la presenza di metastasi linfonodali o a distanza (5). Di seguito descriveremo nuovi approcci terapeutici per la cura delle forme più aggressive del carcinoma tiroideo, e il valore prognostico di nuovi marcatori molecolari utili alla stratificazione prognostica dei pazienti affetti da DTC.
Nuovi approcci molecolari nella diagnosi dei carcinomi tiroidei
La diagnosi dei noduli tiroidei si basa essenzialmente sull’esame citologico del materiale agoaspirato, caratterizzato da una’accuratezza del 84-95%. Il sistema di classificazione citopatologia dei noduli tiroidei, recentemente rivisto dalla Società Italiana di Anatomia Patologica e Citologia, classifica i risultati dell’esame citologico in 7 categorie diagnostiche: TIR 1) non-diagnostico; TIR 1c) non-diagnostico cistico; TIR 2) benigno; TIR 3A) atipie / lesione follicolare di significato indeterminato; TIR 3B) lesioni indeterminate ad alto rischio; TIR 4) sospetto di malignità; TIR 5) maligno (4). Le categorie diagnostiche TIR 3 rappresentano una zona grigia in cui la citologia non può discriminare fra una lesione maligna (i.e. FTC e variante follicolare del PTC) e una benigna (i.e. adenoma follicolare e gozzo nodulare) (4). Di conseguenza, una diagnosi TIR 3 pone l’indicazione all’intervento di tiroidectomia perché solo la valutazione istologica post-chirurgica può differenziare queste neoplasie. In tali condizioni, circa l’80% degli interventi chirurgici si rivela superfluo. E’ dunque auspicabile l'identificazione di nuovi parametri in grado di migliorare l’accuratezza diagnostica dell’esame citologico.
Negli ultimi anni, due diversi approcci molecolari sono stati proposti per risolvere l’incertezza diagnostica legata ai referti TIR 3 (6, 7). Il primo, propone di differenziare i noduli benigni da quelli maligni in base alla presenza o meno nel materiale agoaspirato di una delle sette mutazioni più comunemente riscontrate nei DTC. Queste includono i riarrangiamenti RET/PTC1, RET/PTC3 ePAX8/PPARg, e le mutazioni puntiformi BRAFV600E, HRAS (codone 61), KRAS (codoni12 e 13) e NRAS (codone 61). In uno studio prospettico si è rilevato come circa il 90% dei pazienti con TIR 3 recanti una delle mutazioni suddette avesse all’esame istologico un tumore maligno (6). I falsi positivi, rivelatisi adenomi follicolari all’esame istologico, erano dovuti al riscontro di mutazioni del gene RAS. Se però si considera che gli adenomi follicolari con mutazioni del gene RAS sono ritenuti lesioni precancerose questi risultati sono ancora accettabili. Meno accettabile è l'alta percentuale di falsi negativi (32-43%), responsabile di una bassa sensibilità del test. Il secondo approccio, noto come “gene-expression classifier” (GEC), è volto ad individuare nei pazienti TIR 3 i casi benigni, piuttosto che quelli maligni, con l'obiettivo principale di ridurre le tiroidectomie inutili (7). Il GEC consiste in un microarray che analizza l'espressione di 167 geni diversi a partire da RNA estratto da materiale agoaspirato. In uno studio prospettico multicentrico di noduli con citologia TIR 3, come prevedibile per un test inteso a identificare l’assenza del cancro, il valore predittivo negativo era di circa il 90% nelle categorie diagnostiche TIR 3. Tuttavia, il test è risultato avere una bassa specificità ed un basso valore predittivo positivo.
In conclusione, pur rappresentando un potenziale miglioramento della diagnostica dei noduli tiroidei, i due metodi suddetti risentono ancora di incertezze che ne limitano al momento l’applicazione clinica. È possibile che in un prossimo futuro tali lacune siano colmate grazie all'identificazione di ulteriori geni connessi con la trasformazione maligna del tireocita.
Diagnosi molecolare di metastasi da carcinoma differenziato della tiroide (DTC) nei linfonodi cervicali (CLN)
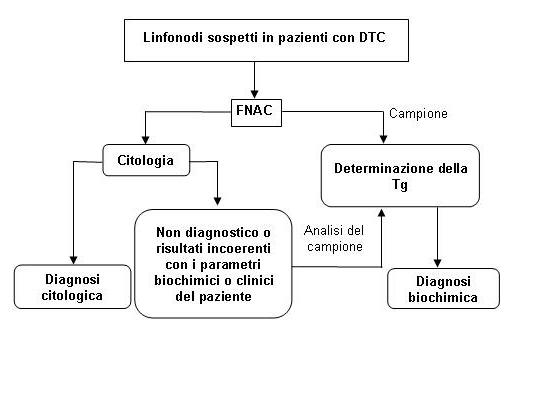
La diagnosi delle metastasi linfonodali da DTC è fondamentale per l'approccio chirurgico iniziale così come per la stratificazione prognostica e il follow-up dei pazienti. La FNAC rappresenta la tecnica di elezione per la diagnosi di CLN sospetti di replicazione metastatica da DTC, nonché da altri tumori primari (8). L’accuratezza diagnostica della tecnica varia dal 73% al 94% e dipende essenzialmente dall’esperienza del citopatologo. In circa il 20% dei campioni la diagnosi citologica è impedita dalla scarsa cellularità o non rappresentatività del campione prelevato, spesso dovuto alla natura cistica dei linfonodi (9). Per risolvere questo problema, è stato introdotto il dosaggio della Tg nel materiale residuo dell'ago utilizzato per la FNAC (10). La performance diagnostica del test è eccellente, avendo un’accuratezza prossima al 100%. Sulla base di queste evidenze alcuni autori raccomandano la rilevazione della Tg di routine unitamente alla FNAC nella diagnosi preoperatoria di linfonodi sospetti. Tuttavia, è stato dimostrato che l’accuratezza diagnostica della Tg non è statisticamente superiore a quella della FNAC, né la combinazione delle due metodiche migliora l'accuratezza diagnostica della sola FNAC (11). D’altronde, la determinazione della Tg è essenziale nei casi in cui l’esame citologico risulta inadeguato o quando la diagnosi citologica è incoerente con i parametri clinici e/o biochimici del paziente. Si è quindi proposto che i campioni per la determinazione della Tg siano sempre raccolti, ma limitando la loro analisi ai casi in cui la diagnosi citologica sia dubbia o assente (Figura 2).
Nuovi marcatori molecolari per la prognosi del carcinoma differenziato della tiroide (DTC)
Il principale sistema di stadiazione per i pazienti affetti da DTC è rappresentato dal TNM, basato sulle dimensioni del tumore (T) e la presenza/assenza di metastasi linfonodali (N) o a distanza (M), e inoltre distingue i pazienti in due fasce di età, assegnando una prognosi peggiore a quelli sopra i 45 anni a parità di altri fattori (5). Tuttavia, il TNM, include nello stesso gruppo di rischio pazienti che mostrano progressioni tumorali ed intervalli liberi da malattia molto diversi fra loro (12). Per questo motivo, è stato proposto di integrare i parametri TNM con caratteristiche cliniche aggiuntive, come la variante istologica, i risultati della scintigrafia ed i livelli sierici della Tg (13). Tuttavia, con questo nuovo sistema di stratificazione i pazienti inclusi nello stesso gruppo di rischio continuano a mostrare comportamenti clinici eterogenei. E’ quindi auspicabile l'identificazione di ulteriori fattori prognostici in grado di migliorare la stratificazione prognosi di questi pazienti. In questo contesto, la mutazione BRAFV600E, l'alterazione genetica più diffusa osservata nel 29-87% dei PTC, ha ricevuto una notevole attenzione come nuovo marcatore prognostico (14). Diversi studi ne hanno evidenziato l'associazione con fattori prognostici classici inclusi un ridotto intervallo libero da malattia e la sopravvivenza (15). Tuttavia, nonostante l'entusiasmo iniziale, la rilevanza clinica di questi risultati è attualmente oggetto di dibattito, in quanto ulteriori studi smentiscono l’associazione tra la mutazione e la prognosi dei pazienti (14). Inoltre, la frequenza della mutazione BRAFV600E in questi pazienti è elevata (circa il 50%), rispetto alla percentuale di recidive riscontrate (circa il 20%). Di conseguenza, basandosi unicamente sull'analisi della mutazione BRAFV600E, una percentuale importante di pazienti sarebbe sottoposta a sovra- o sottotrattamento. Negli ultimi anni, è stato valutato il valore prognostico dei componenti del sistema di attivazione urochinasico del plasminogeno (uPAS) nei pazienti affetti da PTC. L’uPAS comprende l'attivatore urochinasico del plasminogeno (uPA), il suo recettore di membrana (uPAR) e l'inibitore dell'attivatore del plasminogeno-1 (PAI-1) (15). L’uPAS controlla diversi processi fisiopatologici tra cui la progressione tumorale, in cui induce la degradazione della matrice extracellulare, l’attivazione di fattori di crescita latenti, la proliferazione cellulare, la diffusione metastatica e la neo-angiogenesi tumorale (15). Il valore prognostico di componenti dell’uPAS è stato caratterizzato in diversi tipi di cancro e, di regola, l’iperespressione di uno o più di essi risulta associata a un più alto rischio di recidiva. Nei PTC l’iperespressione di uPA e uPAR associa positivamente con la presenza di metastasi linfonodali, gli stadi TNM avanzati e con l’intervallo libero da malattia (16). Inoltre, un'elevata espressione di uPA e PAI-1 correla con la sopravvivenza di questi pazienti (17). Nel complesso, tali risultati suggeriscono l’opportunità di effettuare ulteriori indagini per confermare il valore prognostico dei componenti dell’uPAS nel cancro della tiroide. Recentemente, altri marcatori molecolari potenzialmente utili per la prognosi dei pazienti affetti da PTC sono stati descritti ed includono l’isoforma b del recettore degli estrogeni e il microRNA 146b (18).
In conclusione, negli ultimi anni è stata identificata una serie di nuovi marcatori molecolari potenzialmente in grado di migliorare la stratificazione prognostica dei pazienti affetti da DTC. Ulteriori indagini cliniche, comprendenti studi multicentrici prospettici su un ampio numero di pazienti, saranno necessarie per stabilire l’effettiva utilità del loro impiego clinico. L’introduzione di fattori prognostici di tipo molecolare potrebbe integrare le informazioni derivanti dai parametri clinici portando ad un miglioramento dell’attuale sistema di stadiazione e conseguentemente ad un approccio terapeutico ed un follow-up basati sulle reali esigenze dei singoli pazienti.
Nuovi approcci terapeutici
Come accennato la tiroidectomia totale seguita da terapia adiuvante con 131I è il trattamento di elezione per la cura dei pazienti affetti DTC. Tale approccio terapeutico, tuttavia, fornisce risultati inadeguati nelle recidive resistenti al trattamento con 131I, nelle forme scarsamente differenziate e nei carcinomi anaplastici della tiroide. In questi ultimi infatti la terapia chirurgica, la radioterapia loco-regionale e la chemioterapia forniscono risultati deludenti. Attualmente sono in fase di sperimentazione preclinica e clinica differenti inibitori di chinasi implicate nella patogenesi dei tumori tiroidei (vedi figura 1) (19). Alcuni di questi, fra cui sorafenib, imatinib and axitinib, si sono dimostrati in grado di indurre una risposta parziale (riduzione della massa tumorale di oltre il 30%) o una stabilizzazione della malattia in una percentuale rilevante di pazienti. Il trattamento con questi farmaci non è tuttavia scevro di effetti collaterali che includono ipertensione, insufficienza cardiaca, tromboembolismo arterioso, infarto acuto del miocardio, emorragie, insufficienze cardiopolmonari, diarrea, reazioni cutanee, insufficienza renale ed epatica.
Bibliografia
1. Gospodarowicz MK, Henson DE, Hutter RVP, et al. Prognostic factors in cancer 2nd ed. New York: Wiley-Liss, 2001.
2. Nikiforov YE, Ohori NP, Hodak SP, et al. (2011) Impact of mutational testing on the diagnosis and management of patients with cytologicallyindeterminate thyroid nodules: a prospective analysis of 1056 FNA samples. J Clin Endocrinol Metab 96:3390-3397.
3. Alexander EK, Kennedy GC, Baloch ZW, et al. (2012) Preoperative diagnosis of benign thyroid nodules with indeterminate cytology. New Engl J Med 367:705-715.
4. Stack BC Jr, Ferris RL, Goldenberg D, et al. (2012) American thyroid association consensus review and statement regarding the anatomy, terminology, and rationale for lateral neck dissection in differentiated thyroid cancer. Thyroid 22:501–508.
5. Ustün M, Risberg B, Davidson B, et al. (2002) Cystic change in metastatic lymph nodes: A common diagnostic pitfall in fine-needle aspiration cytology. Diagn Cytopathol 27:387-392.
6. Pacini F, Fugazzola L, Lippi F, et al. (1992) Detection of thyroglobulin in fine needle aspirates of nonthyroidal neck masses: a clue to the diagnosis of metastatic differentiated thyroid cancer. J Clin Endocrinol Metab 74:1401-1404.
7. Baldini E, Sorrenti S, Di Gioia C, et al. (2013) Cervical lymph node metastases from thyroid cancer: does thyroglobulin and calcitonin measurement in fine needle aspirates improve the diagnostic value of cytology? BMC Clin Pathol 13:7.
8. Pacini F, Castagna MG, Brilli L, et al. (2012) Thyroid cancer: ESMO clinical practice guidelines for diagnosis treatment and follow-up. Ann Oncol 23:vii110-119.
9. American Thyroid Association (ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer, Cooper DS, Doherty GM, et al. (2009) Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 19:1167-1214.
10. Xing M (2007) BRAF mutation in papillary thyroid cancer: pathogenic role, molecular bases, and clinical implications. Endocr Rev 28:742-762.
11. Ulisse S, Baldini E, Sorrenti S, et al. (2009) The urokinase plasminogen activator system: a target for anti-cancer therapy. Curr Cancer Drug Tar 9:32-71.
12. Ulisse S, Baldini E, Sorrenti S, et al. (2011) High expression of the urokinase plasminogen activator and its cognate receptor associates with advanced stages and reduced disease-free interval in papillary thyroid carcinoma. J Clin Endocrinol Metab 96:504-508.
15. Antonelli A, Fallahi P, Ulisse S, et al. (2012) New targeted therapies for anaplastic thyroid cancer. Anti-Cancer Ag Med Chem 12:87-93.
Massimino D’Armiento e Salvatore Ulisse
Cattedra di Endocrinologia, Centro Malattie della Tiroide, “Sapienza” Università di Roma