“Chirurgia dei Linfatici: un Nuovo ed Avanzato Modello
Sperimentale per il Training in Microchirurgia”
Corrado Cesare Campisi
Introduzione
Il linfedema periferico che, negli
stadi più avanzati, può anche causare significativa morbilità in termini sia di
riduzione della mobilità che di rischio d’infezioni1, 2, continua,
purtroppo, ad essere una patologia scarsamente riconosciuta. Grazie però alla
messa a punto di tecniche microchirurgiche estremamente raffinate (MLVA
–anastomosi linfatico-venose multiple; MLVLA –anastomosi
linfatico-veno-linfatiche multiple) atte a ripristinare il flusso linfatico, è
possibile ottenere una riparazione funzionale con eccezionali risultati clinici
a lungo termine ampliamente riportati in letteratura3. Recentemente,
tra i nuovi trattamenti del linfedema, si registrano anche il Lymph Nodal
Transfer (Trasferimento Linfonodale) (LNT) 4 e il Lymph Vessel
Transplantation (Trapianto dei linfatici) (LVT), entrambi metodi atti a superare
le eventuali ostruzioni al flusso linfatico5, 6 , e la cui efficacia,
misurata in termini di riduzione volumetrica dell’arto interessato e stabilità a
lungo termine, varia moltissimo da un centro chirurgico all’altro7-9.
Il consenso generale secondo il quale il trattamento chirurgico del linfedema
debba essere fatto presso centri specializzati rappresenta nel contempo un
fattore limitante per i milioni di pazienti affetti da questa patologia in tutto
il mondo.
Mancano però i modelli
sperimentali adeguati in grado di verificare, con studi proof-of-concept,
la validità dei trattamenti chirurgici, sia esistenti che emergenti, del
linfedema (per esempio: pervietà a lungo termine dell’MLVA, meccanismi di
modulazione del flusso linfatico dopo LNT, linfangiogenesi), il che a sua volta
crea grosse difficoltà nel trovare una certa concordanza a livello
internazionale sulle tecniche microchirurgiche e la loro efficacia. A questo
proposito, Hadamistzky et al. ha sottolineato la necessità urgente di
modelli animali di linfedema secondario 10. Sono già stati messi a
punto numerosi modelli di topo, sui quali si studiano gli effetti della
linfostasi sui tessuti in casi di linfedema primario e secondario e che hanno
già permesso di aumentare le nostre conoscenze sul ruolo dell’infiammazione e
dell’infezione 11-13. Ad esempio, i topi Sprague Dawley sono stati
utilizzati come modello di training dei chirurghi alla preparazione delle
anastomosi14, e, ancora più recentemente, per addestrarsi nella
supermicrochirurgia con vasi di calibro al di sotto del millimetro 15,
modelli che, però, presentano svariate limitazioni nel momento in cui tali
tecniche devono essere trasferite sull’uomo 16. Infatti, nell’uomo,
per la sua posizione eretta, le condizioni idrostatiche, in particolare degli
arti inferiori, sono molto diverse 16. Inoltre, dal momento che
nell’uomo i vasi linfatici rigenerativi devono coprire distanze ben più grandi,
sono stati messi a punto modelli su animali di taglia più grossa17-19
, specialmente per l’ LNT16, 20. Benché in letteratura si siano
pubblicati alcuni risultati ottenuti con modelli ovini e canini per l’LNT, la
loro applicabilità nell’addestramento dei chirurghi 21, 22 è comunque
limitata dalla diversità anatomica tra questi animali e l’uomo.
Al momento, per il trattamento del
linfedema nell’uomo, per studiare l’efficacia dell’LNT e la terapia con il
fattore di crescita 16, 20 , vengono impiegati modelli suini. Alcuni
trial condotti su un piccolo numero di pazienti hanno dimostrato un discreto
successo ottenuto con l’LNT nel ridurre i sintomi in pazienti con linfedema
secondario post-mastectomia 23. Tuttavia, la complessità
dell’intervento chirurgico unita a problematicità di morbilità nella sede del
prelievo dei linfonodi 24 ha ostacolato la diffusione del trapianto
di linfonodi alla pratica clinica 17. Al contrario, l’LNT si è potuto
sviluppare in centri specializzati, sulla base dell’esperienze ivi maturate
negli ultimi 20 anni con altre tecniche microchirurgiche, quali ad esempio l’MLVA
- MLVLA, tecniche miranti ad aumentare la quantità di linfa che rientra nel
circolo ematico e le cui casistiche sono state ampiamente pubblicate in
letteratura con i migliori risultati di pervietà dei vasi a lungo termine e con
il follow-up più lungo 3, confermando quindi la possibilità di
trattare e curare il linfedema, con i migliori risultati ottenuti nel caso di
microchirurgia precoce25. Un modello di formazione efficace
contribuirebbe inoltre ad una maggiore diffusione di entrambi i trattamenti
chirugici (MLVA – MLVLA; LNT).
Materiali e metodi
Obiettivo del presente lavoro è
stato lo sviluppo di un modello microchirurgico sperimentale in vivo di MLVA e
LNT, come parte di un programma di formazione avanzata in microchirurgia. Come
modello di training è stato scelto quello suino, data la sua similarità con
l’uomo, sia dell’anatomia che del calibro dei vasi. Tutte le procedure descritte
nel presente lavoro sono state condotte presso il Pius Branzeu Center, Victor
Babes dell’Università di Medicina e Farmacia di Timisoara e approvate dal
Comitato Etico e per la Cura degli Animali dello stesso Istituto. L’impiego di
maiali vivi in anestesia generale dà la possibilità di verificare per mezzo del
BPV, della linfoscintigrafia e microlinfografia PDE, la pervietà, a breve e
lungo termine, delle anastomosi realizzate, cosa che non sarebbe possibile in
modelli ex vivo.
Cinque scrofe comuni (Sus scrofa
domesticus) del peso di 20 – 28 kg sono state sottoposte ad anestesia
generale. Per la visualizzazione dei linfatici (fig. 1), è stata effettuata,
bilateralmente, un’iniezione per via endovenosa e sottocutanea (iniezione
superficiale e sottocutanea profonda) di 0,5 mL di colorante Blue Patent Violet
(BPV, un sale monosodico di metanolo) nella coscia media e laterale dell’arto
caudale.
Le strutture linfonodali della
regione inguinale e la distribuzione dei linfatici nell’uomo si differenziano
dal modello sperimentale suino utilizzato, dal momento che nel suino vi è un
solo grande linfonodo superficiale (fig 2B) in corrispondenza di ogni estremità,
mentre nell’uomo sono presenti stazioni linfonodali superficiali composte da
numerosi linfonodi. Il linfonodo superficiale nel suino drena la linfa
proveniente dai collettori afferenti della coscia (fig. 2A, 2B). E’ stato
individuato un solo collettore che scorre lateralmente alla vena safena, mentre
i collettori principali (3-5) si trovano a livello della coscia mediale (fig.
2A).
Risultati
Realizzazione delle MLVA
Sono state preparate le MLVA
tramite un’unica incisione nella regione sotto-inguinale, con sviluppo mediale e
parallelo alle vene safene. A seguito dell’iniezione di BPV, si sono potute
visualizzare le strutture superficiali linfatiche-linfonodali, a cui è seguito
l’isolamento accurato di tutti i vasi linfatici afferenti (fig. 3), gran parte
dei quali sfociavano nell’unico linfonodo inguinale, mentre altri interessavano
le strutture sotto-fasciali profonde. Per l’anastomosi MLV, si è quindi
proceduto alla preparazione di alcuni vasi linfatici risultati sani
all’osservazione e situati nell’unica sede operatoria (fig. 4), questo per
simulare il risultato corretto derivante dalla giusta resezione delle strutture
linfatiche-linfonodali. Il grande vantaggio di questa tecnica microchirurgica è
dato dalla possibilità di anastomizzare molti collettori linfatici afferenti (e
non solo uno, come in altre tecniche) ad una vena competente dotata di apparato
valvolare adeguato e senza reflusso (fig. 7B). Un punto a U (per il quale si
utilizzano suture in prolene da 8/0 a 10/0 a seconda del calibro del vaso) fa da
guida all’ingresso telescopico dei collettori linfatici nella vena. La seconda
fase della preparazione dell’anastomosi consiste nell’aggiunta di qualche punto
tra il bordo della vena e il tessuto peri-linfatico, in modo da poter rimuovere
il primo punto a U, lasciando quindi liberi i collettori linfatici all’interno
del segmento di vena competente precedentemente individuato.
LNT
Con il modello sperimentale
proposto nel presente studio, è possibile realizzare un training avanzato
dedicato a questa tecnica microchirurgica del trasferimento dei linfonodi (LNT).
Infatti, con un’accurata resezione è possibile identificare il linfonodo
superficiale che drena i collettori afferenti provenienti dall’estremità caudali
(fig. 5). In particolare, così come nell’uomo, si è dimostrato che la linfa
entra dal lato convesso del linfonodo attraverso i vasi linfatici afferenti
(ovvero i collettori superficiali dominanti a livello della coscia mediale),
quindi scorre attraverso i seni linfonodali uscendo dalla regione del linfonodo
detta ilo, da cui emergono un vaso linfatico efferente, un’arteria e due vene
(fig. 6).
Discussione
Abbiamo descritto un
modello suino flessibile in vivo per il training in microchirurgia linfatica,
comprendente le tecniche MLVA e LNT. Non si sono registrate complicanze
post-operatorie, il che conferma la sicurezza e l’efficacia del modello in
questione, che si è anche dimostrato adattabile e con un buon rapporto
costo/benefici, anche perché su ogni animale si possono realizzare più tecniche
(linfoscintigrafia con iniezione di BPV, MLVA, LNT).
Per la mancanza di
modelli di training adeguati per la microchirurgia linfatica e a causa dei tempi
e costi dei programmi specifici di specializzazione, è aumentato l’interesse per
modelli virtuali di formazione in microchirurgia, con la recente messa a punto
di simulazioni vascolari che permettono ai chirurghi di praticare suture di vasi
sanguigni virtuali 27,28. Queste simulazioni risultano comunque
limitate rispetto alla chirurgia in vivo, poiché non offrono sufficienti
variazioni delle tipologie di interventi possibili e non danno al chirurgo il
necessario feedback tattile, quale ad esempio quello determinato dalla pressione
delle dita sul bisturi, benché Wang et al.28 stia mettendo a punto
per il proprio sistema di simulazione di chirurgia virtuale dei bisturi tattili.
Con il nostro sistema di formazione con modello suino, invece, il chirurgo può
fare pratica con le tecniche microchirurgiche in vivo su vasi di calibro simile
a quelli presenti nell’uomo. Inoltre, così come per l’uomo, il modello presenta
variazioni anatomiche naturali, il che permette al chirurgo di adattare o
modificare la tecnica di volta in volta, offrendo un’esperienza formativa più
realistica.
Conclusioni
Il nostro modello
suino è già operativo all’interno di una sala operatoria vera e propria ed
utilizza tessuti in vivo, il che è garanzia di un’esperienza formativa
realistica e ottimale, grazie al nostro nuovo modello di formazione alla
microchirurgia, il cui punto di forza, secondo noi, è dato dalla disponibilità
di una piattaforma di training per i chirurghi, prima di entrare in sala
operatoria (SO). Si tratta inoltre di un sistema con un buon rapporto
costo-benefici, grazie alla flessibilità del modello suino nel dare al chirurgo
la possibilità di fare pratica su vasi simili a quelli presenti nell’uomo,
utilizzando le varie tecniche che dovranno applicare in sala operatoria, tra cui
ad esempio l’MLVA, LNT o le biopsie linfonodali.
Altro elemento essenziale
del nostro lavoro è che esso rappresenta un punto di partenza per ulteriori
ricerche e studi sulla pervietà a lungo termine dei trattamenti microchirurgici
del linfedema cronico. Mentre gli altri modelli animali sono limitati, non solo
per la loro diversità rispetto all’anatomia dell’uomo, ma anche per la grande
differenza in termini di aspettativa di vita, i modelli suini permettono un
follow-up più lungo riguardo alle diverse tecniche chirurgiche. Ad esempio, la
variabilità di localizzazione e di tipologia delle LVA che vengono attualmente
realizzate nell’uomo7-9 comporta a sua volta una variabilità
nell’efficacia e durata a lungo termine dell’intervento. Vista anche la
comprovata efficacia di un intervento microchirurgico precoce, sarebbe ora che
le ricerche sul trattamento delle patologie linfatiche cominciassero a dedicarsi
maggiormente allo studio dettagliato delle tecniche microchirurgiche, sperando
che il nostro modello di training per i chirurghi possa servire a colmare il
divario esistente.
|
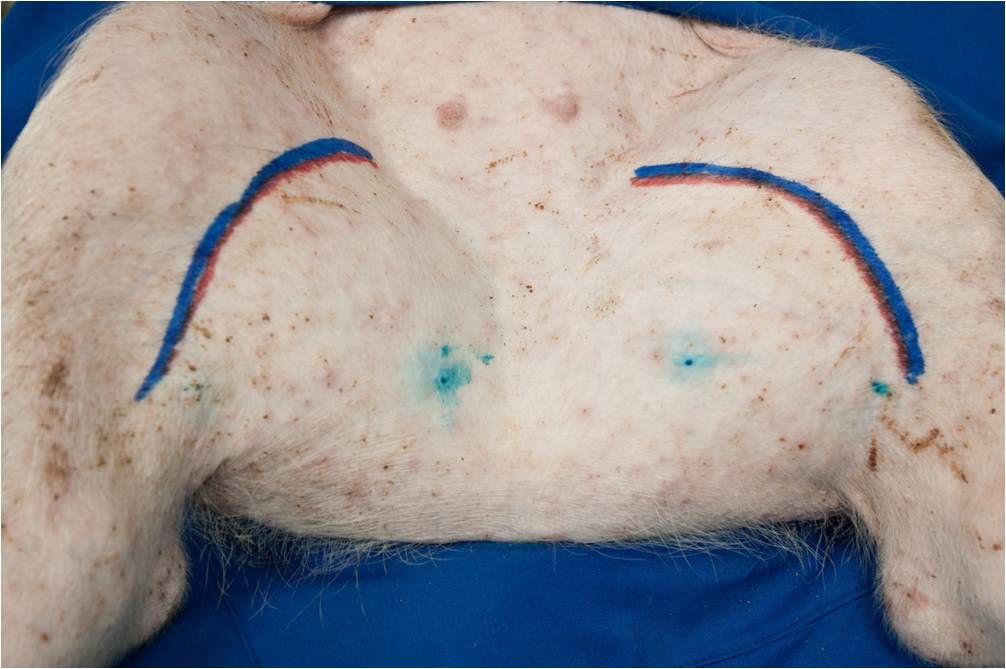
Fig. 1 -
Iniezione BPV |
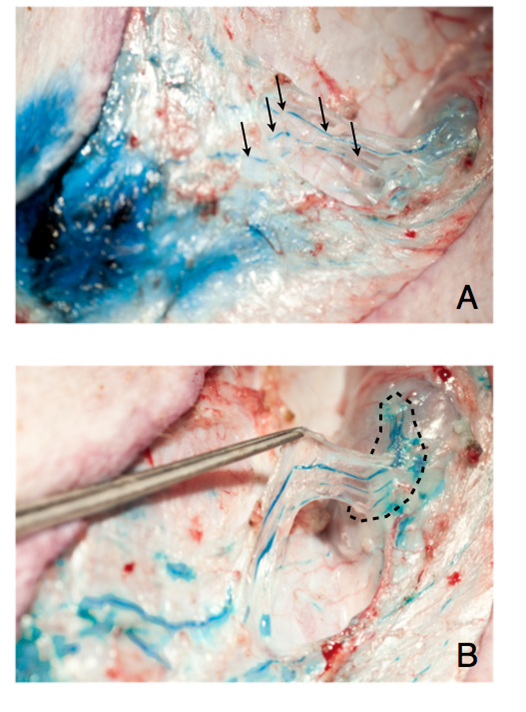
Fig. 2. (A)
collettori linfatici afferenti (frecce nere) e loro traiettoria sul lato
mediale della coscia; (B) l'intera rete linfatica è drenato da un
singolo linfonodo nella regione inguinale (linea tratteggiata) |
|
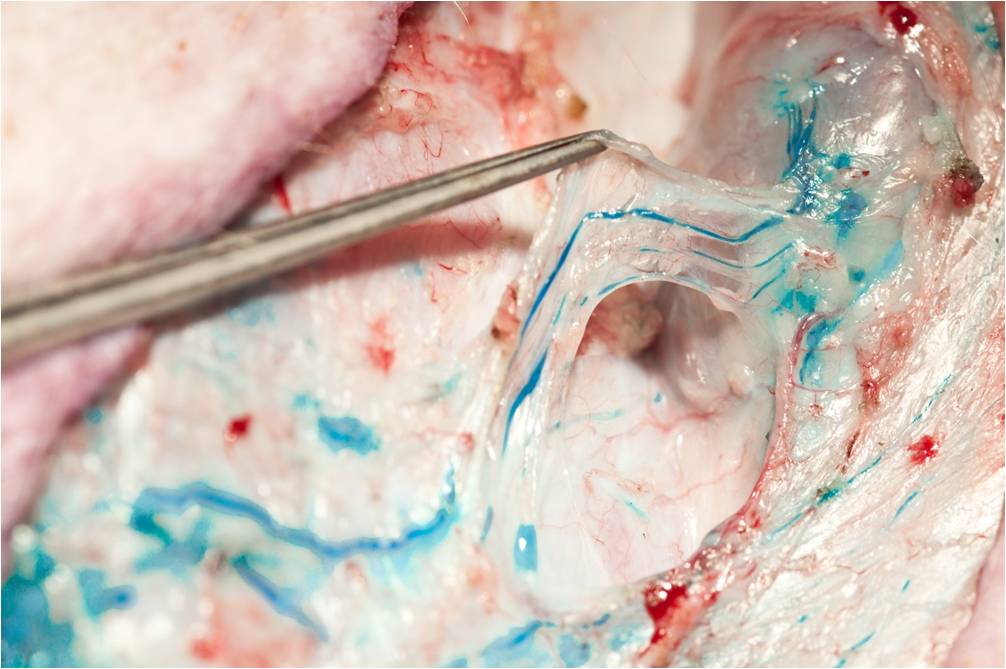
Fig. 3 (A – sopra;
B – sotto) (A) vena safena e linfatici; (B) MLVA pronto per essere
effettuata |
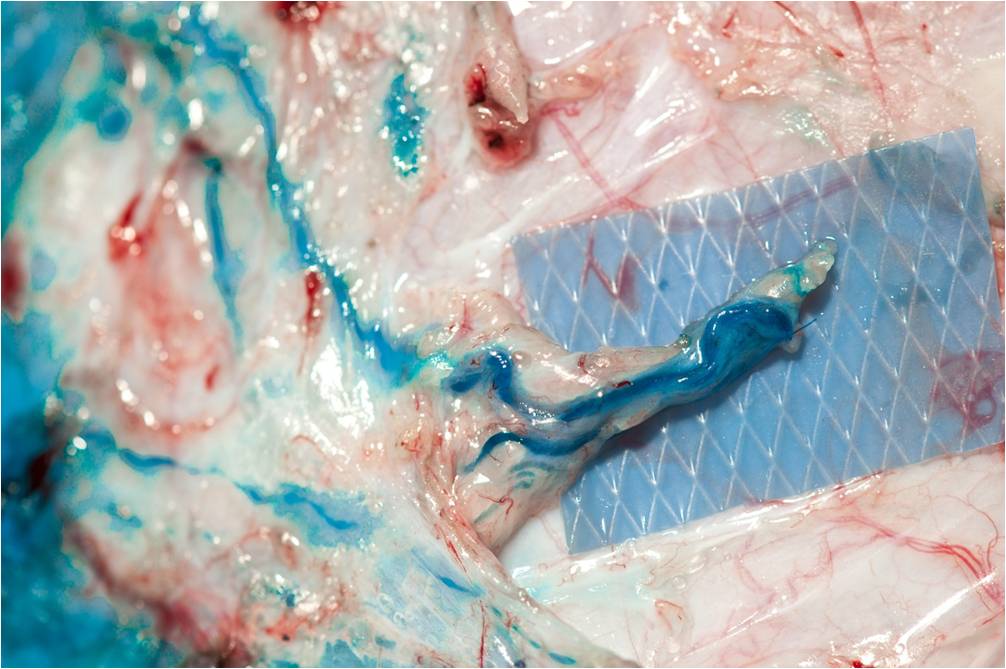
Fig. 4 |
|
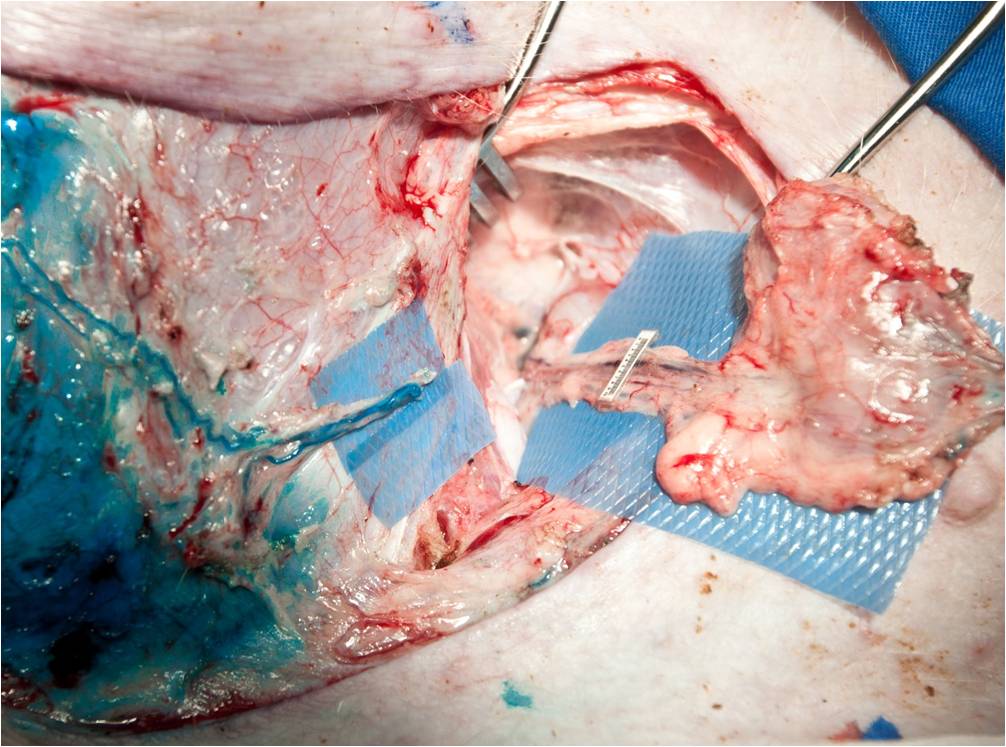
Fig. 5 |
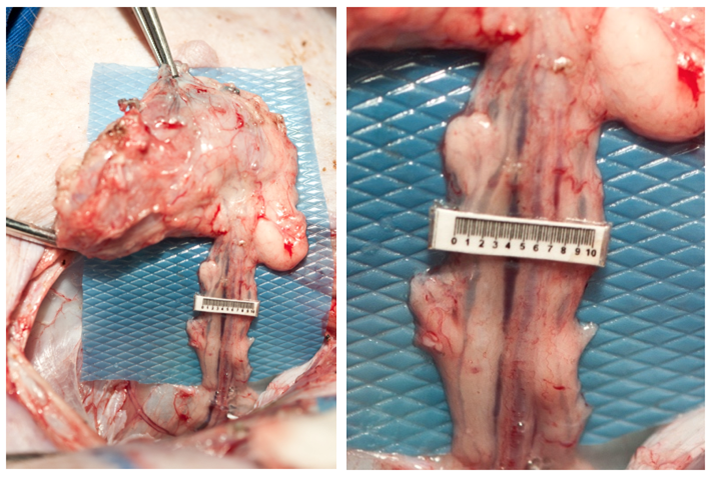
Fig. 6 |
|
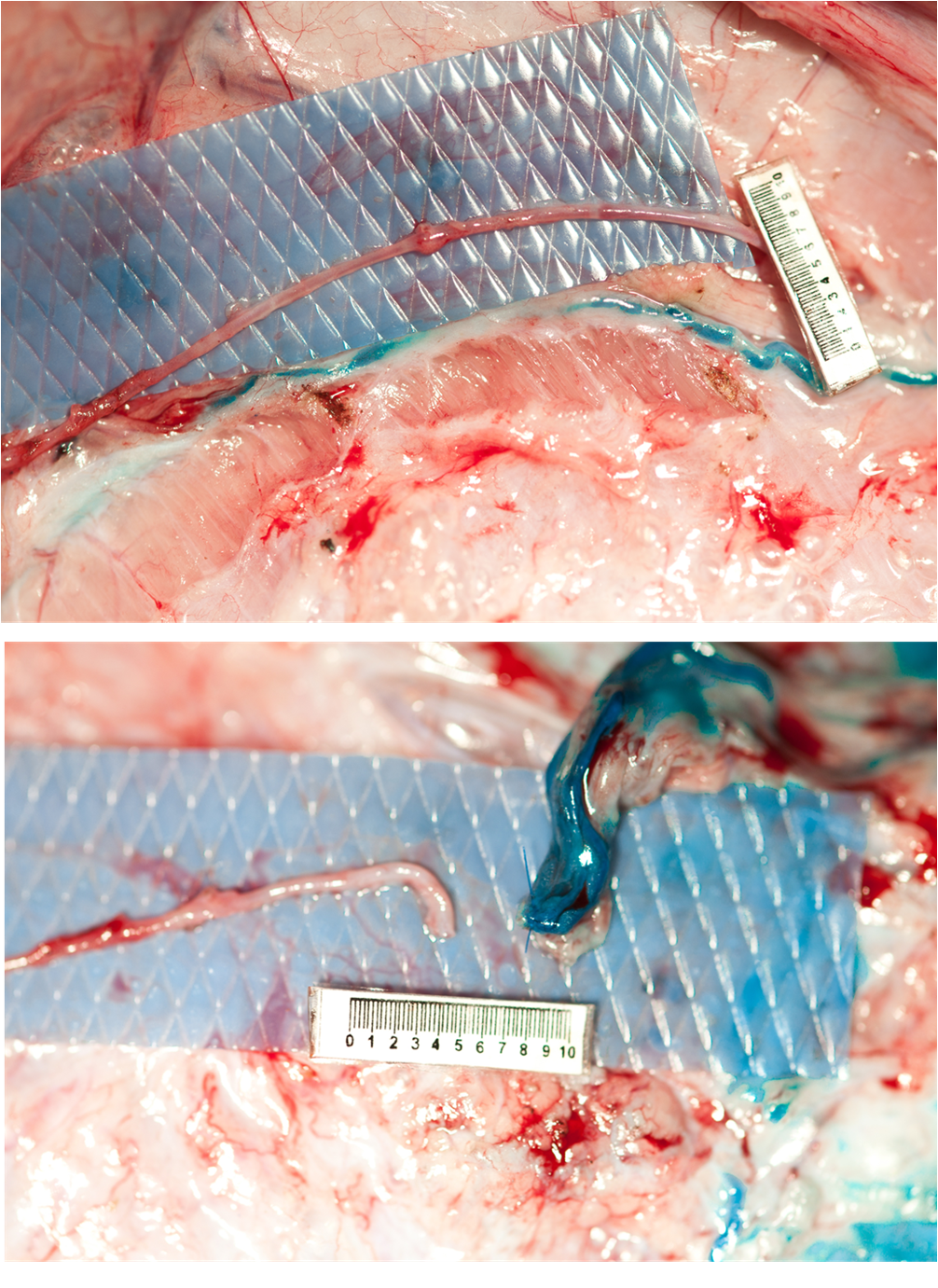
Fig. 7
|
Bibliografia
1
Gethin G, Byrne D, Tierney S et al. Prevalence of lymphoedema and quality of
life among patients attending a hospital-based wound management and vascular
clinic. Int Wound J. 2012 Apr;9(2):120-125.
2
Morgan PA, Murray S, Moffat CJ et al. The challenges of managing complex
lymphoedema/chronic oedema in the UK and Canada. Int Wound J. 2012
Feb;9(1):54-69.
3 Campisi C, Bellini C, Campisi C et al.
Microsurgery for lymphedema: clinical research and long-term
results. Microsurgery. 2010 May;30(4):256-260.
4
Viitanen TP, Visuri MT, Hartiala P et al. Lymphatic vessel function and
lymphatic growth factor secretion after microvascular lymph node transfer in
lymphedema patients. Plastic and Reconstructive Surgery – Global Open. 2013
May;1(2):1-9.
5
Baumeister RGH, Frick A. The microsurgical lymph vessel transplantation.
Handchir Mikrochir plast Chir 2003;35:202-209.
6
Felmerer G, Sattler T, Lohrmann C, Tobbia D. Treatment of various secondary
lymphedemas by microsurgical lymph vessel transplantation. Microsurgery.
2012;32:171–177.
7
Mehrara B, Zampell JC, Suami H, Chang DW. Surgical management of lymphedema:
Past, present, and future. Lymphat Res Biol 2011;9:159-167.
8
Cormier JN, Rourke L, Crosby M, et Al.. The surgical treatment of lymphedema:
a systematic review of the contemporary literature (2004-2010). Ann Surg
Oncol 2012;19:642-651.
9
Lopez Penha TR, Ijsbrandy C, Hendrix NAM, et al. Microsurgical techniques for
the treatment of breast-cancer related lymphedema: a systematic review. J
Reconstr Microsurg 2013;29:99-106.
10
Hadamitzky C, Pabst R. Acquired lymphedema: an urgent need for adequate
animal models. Cancer Res. 2008 Jan;68(2):343–345.
11
Rutkowski JM, Markhus CE, Gyenge CC et al. Dermal collagen and lipid
deposition correlate with tissue swelling and hydraulic conductivity in murine
primary lymphedema. Am J Pathol. 2010 Mar;176(3):1122-9.
12
Rutkowski JM, Moya M, Johannes J et al. Secondary lymphedema in the mouse
tail: lymphatic hyperplasia, VEGF-C upregulation, and the protective role of
MMP-9. Microvasc Res. 2006 Nov;72(3):161-71. Melissa Ryan wrote this
13
Zampbell JC, Aschen S, Weitman ES et al. Regulation of adipogenesis by
lymphatic fluid stasis: part I. Adipogenesis, fibrosis, and inflammation.
Plast Reconstr Surg. 2012 Apr;129(4):825-834.
14
Kraemer B, Hoffmann J, Wallwiener M et al. Microsurgical training in a rat
model: an approach and concept for gynecological surgeons. J Obstet Gynaecol
Res. 2010 Oct;36(5):1075-9.
15 Liu
HL. Microvascular anastomosis of submillimeter vessels – a training model in
rats. J Hand Microsurg. 2013 Jan;5(1):14-17.
16
Lähteenvuo M, Honkonen K, Tervala T et al. Growth factor therapy and
autologous lymph node transfer in lymphedema. Circulation. 2011
Feb;123(6):613-620.
17
Baker A, Kim H, Semple JL et al. Experimental assessment of pro-lymphangiogenic
growth factors in the treatment of post-surgical lymphedema following
lymphadenectomy. Breast Cancer Res. 2010;12(5):R70.
18
Tobbia D, Semple J, Baker A et al. Experimental assessment of autologous
lymph node transplantation as treatment of postsurgical lymphedema. Plast
Reconstr Surg. 2009 Sep;124(3):777-786.
19
Tobbia D, Semple J, Baker A et al. Lymphedema development and lymphatic
function following lymph node excision in sheep. J Vasc Res.
2009;46(5):426-434.
20
Blum KS, Hadamitzky C, Gratz KF et al. Effects of autotransplanted lymph node
fragments on the lymphatic system in the pig model. Breast Cancer Res Treat.
2010 Feb;120(1):59-66.
21
Tobbia D, Semple J, Baker A, et Al.. Experimental assessment of autologous
lymph node transplantation as treatment of postsurgical lymphedema. Plast
Reconstr Surg. 2009 Sep;124(3):777-86.
22
Castejon R, Gamallo C, Jimenez-Cossio J. An experimental study of lymphatic
vessel autotransplantation in the dog. Lymphology. 1990 Dec;23(4):194-7.
23
Becker C, Assouad J, Riquet M et al. Postmastectomy lymphedema: long-term
results following microsurgical lymph node transplantation. Ann Surg. 2006
Mar;243(3):313-315.
24
Cheng MH, Chen SC, Henry SL et al. Vascularized groin lymph node flap
transfer for postmastectomy upper limb lymphedema: flap anatomy, recipient
sites, and outcomes. Plast Reconstr Surg. 2013 Jun;131(6):1286-1298.
25
International Society of Lymphology. The diagnosis and treatment of
peripheral lymphedema: 2013 Consensus Document of the International Society of
Lymphology. Lymphology. 2013 Mar;46(1):1-11.
26
Nistor A, Ionac M, Spano A et al. Mastering the approach of internal mammary
vessels: a new training model in pigs. Plast Reconstr Surg. 2013
May;131(5):859e-861e.
27
Brown J, Sorkin S, Latombe JC et al. Algorithmic tools for real-time
microsurgery simulation. Medical Image Analysis. 2002;6(3):289-300.
28
Wang F, Su E, Burdet E et al. Development of a microsurgery training system.
Conf Proc IEEE Eng Med Biol Soc. 2008;2008:1935-8.
Scuola di Scienze Mediche e
Farmaceutiche, Università degli Studi - Genova






