
MALATTIE INFIAMMATORIE INTESTINALI IN ETA’ PEDIATRICA
Marina Aloi e Salvatore Cucchiara
EPIDEMIOLOGIA
La Malattia di Crohn (MC) e la Rettocolite Ulcerosa (RCU) sono malattie infiammatorie intestinali (IBD dall’acronimo inglese Inflammatory Bowel Disease) ad eziologia ignota e decorso cronico, caratterizzato da periodi di attività e di remissione della malattia.
L’incidenza della Malattia di Crohn e della Colite Ulcerosa si attesta rispettivamente intorno al 7 per 100.000 e 11 per 100.000 nella popolazione generale in Nord America e Nord Europa, con una prevalenza di 30-100 su 100.000 per la MC e di 150 su 100.000 per la CU.
In età pediatrica si ha un’incidenza di 4.9 per 100.000 per la MC e 2.2 per 100.000 per la CU (7.4 per 100.000 per le IBD complessivamente). Nell’ultima decade l’incidenza della CU è rimasta invariata, mentre si è assistito a un aumento per la MC, attribuito però ad una diagnosi più precoce piuttosto che ad un reale aumento dell’incidenza stessa.
Entrambe le malattie sono più frequenti in Nord America e in Nord Europa; in Europa meridionale, Sud Africa e Australia la frequenza delle IBD è più bassa, mentre in Asia e Sud America sono rare. Una frequenza particolarmente elevata è stata riscontrata nei soggetti di origine ebraica (13).
EZIOPATOGENESI
Nella patogenesi delle IBD un ruolo chiave è svolto dai fattori genetici.
Il rischio di sviluppare IBD nei parenti di primo grado dei pazienti affetti è del 10%; se un bambino ha entrambi i genitori affetti da IBD ha un rischio del 36% di esserne colpito. È stata dimostrata, inoltre, una concordanza tra gemelli monozigoti del 67% per la MC e del 20% per la CU. Le due malattie possono comparire contemporaneamente nella stessa famiglia e, per la MC, è possibile assistere al fenomeno dell’anticipazione, con un’età di comparsa precoce nella seconda generazione.
Le IBD sono disordini poligenici. I geni del complesso maggiore di istocompatibilità sono importanti determinanti ereditari della suscettibilità alla colite ulcerosa. Nella Malattia di Crohn importanti geni della suscettibilità si trovano al di fuori del complesso HLA: sul cromosoma 16, nel locus IBD1 è stato identificato nel 2001 il gene NOD2/CARD15 (Nucleotide-binding Oligomerization Domain/Caspase Activation and Recruitment Domain), gene coinvolto nell’interazione ospite flora batterica intestinale, la cui mutazione in omozigosi aumenta il rischio di sviluppare la MC del 20-40%. Solo il 20% dei pazienti con MC, tuttavia, è omozigote per questa mutazione, a dimostrazione del fatto che altri loci genici e altri fattori sono coinvolti nella patogenesi della malattia.
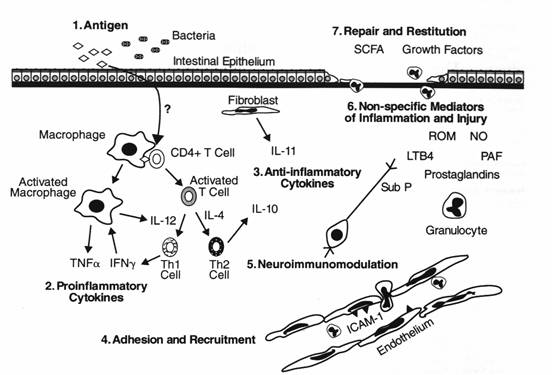
L’interazione tra i microbi e le mucose è molto complessa: esiste un circuito microbo-epitelio-immunità a livello della superficie delle mucose che consente il mantenimento di un’omeostasi. Le proteine NOD2 rappresentano importanti recettori nel normale dialogo tra flora, epitelio e sistema immunitario; una loro mutazione rompe questo equilibrio e apre la via alla cascata delle citochine infiammatorie, tra le quali in primo luogo il TNF-α. L’intestino in condizioni normali si trova in uno stato di costante stimolazione immunologica da parte degli agenti microbici e degli antigeni assunti con la dieta. La fisiologica risposta della mucosa è uno stato di infiammazione “controllata”, cioè la risposta immune nei confronti del contenuto luminale dell’intestino viene inibita. Nei pazienti con IBD, il meccanismo che normalmente mantiene soppressa questa risposta immune non è più efficace. Ne risulta uno stato infiammatorio patologico, in grado di spiegare il quadro clinico e anatomopatologico delle IBD. SHAPE \* MERGEFORMAT
L’influenza dell’ambiente sull’eziologia delle IBD è notevole, tanto che individui che emigrano nei paesi industrializzati acquisiscono il maggior rischio associato a queste regioni.
Tra i fattori esogeni implicati nella genesi delle IBD è conosciuto da tempo il fumo di sigaretta, che aumenta la probabilità di sviluppare la MC, mentre risulta essere protettivo verso la CU. Controverso è il ruolo dell’appendicectomia, che avrebbe un’azione protettiva nei confronti della CU. Sembra che lo stato infiammatorio che precede l’appendicectomia sia in relazione inversa con lo sviluppo di CU.
Molti agenti infettivi (come Salmonella, Shigella, Campylobacter) potrebbero avere un ruolo come fattori scatenanti una IBD attraverso l’induzione di una risposta infiammatoria che il sistema immunitario mucoso non riesce a controllare. Inoltre, in un paziente affetto da IBD, la normale flora microbica commensale dell’ intestino potrebbe essere riconosciuta essa stessa come patogena determinando una reazione immunitaria nei suoi confronti. Microrganismi anaerobi, in particolare le specie di Bacteroides, potrebbero essere responsabili dell’induzione dell’infiammazione.
Fattori psico-sociali possono contribuire alla riacutizzazione dei sintomi della malattia; i pazienti con IBD sembrano avere una personalità caratteristica che li renderebbe più suscettibili agli stress emozionali. Tuttavia le alterazioni della sfera emotiva potrebbero anche essere l’effetto della malattia cronica, che apporta cambiamenti considerevoli nella vita quotidiana del paziente con IBD, soprattutto durante una fase delicata di sviluppo come l’adolescenza.
ASPETTI ANATOMO-PATOLOGICI
Gli aspetti clinici, radiologici, endoscopici e istologici della MC e della CU sono caratteristici e consentono generalmente di porre una diagnosi differenziale tra le due patologie (tabella 1); esiste tuttavia una percentuale di pazienti (20%) con colite cronica in cui non è possibile fare una diagnosi definitiva, si parla allora di Colite Indeterminata.
Non è infrequente, inoltre, che un bambino con diagnosi di CU sulla base delle caratteristiche cliniche venga successivamente riclassificato come MC, con notevoli risvolti sul piano terapeutico.
QUADRO CLINICO
Colite Ulcerosa: i sintomi più frequenti della CU sono la diarrea muco-ematica, il tenesmo, il dolore addominale, spesso notturno, alleviato dalla defecazione.
La gravità dei sintomi dipende dall’estensione della malattia. L’interessamento rettale comporta episodi di rettorragia, tenesmo o urgenza, con sensazione di evacuazione incompleta, meno frequente è il dolore addominale; a volte ci può essere rallentamento del transito intestinale con stipsi. Se la malattia si estende prossimalmente al retto il paziente lamenta dolori addominali crampiformi, presenza di sangue frammisto alle feci o diarrea francamente ematica, spesso notturna e/o post-prandiale.
L’esordio può essere insidioso, con una graduale progressione dei sintomi, ma può anche essere fulminante con febbre, anemia grave, ipoalbuminemia, leucocitosi e più di sei scariche di diarrea muco-ematica in un giorno. La durata dei sintomi è importante per la diagnosi, essendo difficile differenziare tra una colite infettiva subacuta che dura 1-2 settimane e una CU. Generalmente è probabile che si tratti di una IBD se i sintomi durano più di 3-4 settimane. Nella forma moderata-grave della malattia possono esser presenti anche nausea, vomito, anoressia, e calo ponderale.
Nelle adolescenti durante le fasi attive della malattia si può avere amenorrea secondaria
Le indagini di laboratorio evidenziano un aumento degli indici infiammatori: velocità di eritrosedimentazione (VES), proteina C reattiva (PCR), fibrinogeno. La PCR raramente si trova elevata nei pazienti con proctite o proctosigmoidite. La leucocitosi è frequente, ma non è attendibile come indice di attività della malattia. Si riscontra molto spesso un’anemia ipoproliferativa normocromica normocitica causata dall’effetto dell’infiammazione cronica sull’eritropoiesi; a questo si aggiunge la sideropenia dovuta alle perdite ematiche.
È frequente l’ipoalbuminemia e l’elevazione della fosfatasi alcalina e delle aminotrasferasi. I pazienti con CU sono inoltre spesso positivi per i p-ANCA (perinuclear anti-neutrophil cytoplasmic antibodies), con una sensibilità del 40% ed una specificità del 92%.
È importante sottolineare che la colite ulcerosa è una condizione che predispone allo sviluppo di neoplasia del colon. Il rischio sembra aumentare dopo 10 anni di malattia; l’esordio in età pediatrica non sembra incrementare tale rischio. Poiché il cancro del colon è generalmente preceduto dalla displasia si raccomanda l’esecuzione di una colonscopia con biopsia ogni 1-2 anni nei pazienti con malattia di lunga durata.
Malattia di Crohn
Le manifestazioni cliniche della MC dipendono dalla localizzazione della malattia, dal grado dell’infiammazione, dalla presenza di stenosi o fistole.
La sede più frequente è l’ileo terminale e i segni clinici corrispondenti sono episodi ricorrenti di dolore addominale crampiforme localizzato in fossa iliaca destra associato a diarrea, a volte con sangue; il dolore generalmente viene alleviato dalla evacuazione. È spesso presente febbricola. Talvolta il quadro clinico può simulare un’appendicite acuta con dolore, massa palpabile in fossa iliaca destra, febbre elevata e leucocitosi.
La palpazione consente di apprezzare una massa dolorabile a livello del quadrante inferiore destro dell’addome, corrispondente all’ispessimento della parete dell’ultima ansa ileale, al mesentere infiammato e ai linfonodi ingranditi. Nella localizzazione colica i segni più frequenti sono il tenesmo, l’urgenza, la diarrea sanguinolenta. Nella localizzazione digiuno-ileale prevalgono i segni dovuti al malassorbimento, con anemia, ipocalcemia, deficit di vitamine liposolubili da ridotto riassorbimento dei sali biliari, steatorrea, coagulopatia.
Le manifestazioni sistemiche sono più frequenti nella MC che nella CU. Il bambino con MC appare malnutrito e cronicamente malato.
Sono presenti febbre, malessere, facile affaticabilità, calo ponderale (10-20%), e, segno molto importante in età pediatrica, ritardo di crescita (con ritardo della maturazione ossea) e ritardo dello sviluppo puberale. Il ritardo di crescita può anche essere il primo ed unico segno della malattia e può precedere di 1-2 anni le manifestazioni intestinali; esso si presenta come una diminuzione delle massa magra, con preservazione del grasso corporeo. Nel bambino si riscontrano spesso segni di interessamento flogistico perianale (skin tags) e afte ricorrenti del cavo orale. L’adolescente può soffrire di fistole, ragadi e ascessi perirettali; non infrequente l’amenorrea primaria o secondaria.
A volte possono esser presenti anoressia, nausea e vomito.
L’occlusione è una complicanza tipica della malattia di Crohn, tanto frequente che i 2/3 dei pazienti va incontro nella vita ad almeno un intervento chirurgico. Nelle fasi iniziali si ha edema della parete e spasmo, con dolori postprandiali e borborigmi. Dopo alcuni anni l’intestino diventa fibroso e si formano le stenosi. Queste causano veri episodi subocclusivi ed occlusivi, che quasi sempre si risolvono con terapia medica, ma il cui trattamento definitivo resta chirurgico.
I dati di laboratorio caratteristici della MC sono un aumento degli indici infiammatori (VES e PCR). Si può avere anemia, spesso con una componente sideropenica, trombocitosi, leucocitosi, ipoalbuminemia, aumento dell’α1-antitripsina fecale, indice di enteropatia proteino-disperdente e aumento della calprotectina fecale, marker di infiammazione intestinale.
Caratteristica della MC è la positività degli ASCA (anticorpi contro il Saccharomyces Cerevisiae), con una sensibilità del 40-60% ed una specificità intorno al 98%. Nei pazienti con localizzazione colica si può avere una positività per i p-ANCA (5-10% dei pazienti).
Diagnosi differenziale
In età pediatrica la diagnosi di Malattia Infiammatoria Intestinale può porre problemi di diagnosi differenziale perché numerose sono le patologie che possono presentarsi con sintomatologia clinica e, a volte, con aspetto endoscopico simile a quello delle IBD.
Le prime condizioni da escludere sono le infezioni gastrointestinali. Prima di porre diagnosi di IBD bisogna effettuare coprocoltura ed esame parassitologico delle feci e, nei pazienti con anamnesi positiva per l’uso di antibiotici, la ricerca della tossina del Clostridium difficile; la colite pseudomembranosa da C.Difficile si manifesta, infatti, con diarrea acquosa, tenesmo, nausea e vomito e generalmente si sviluppa in seguito a terapia antibiotica prolungata con conseguente disregolazione della flora batterica intestinale.
I patogeni che più frequentemente danno quadri di colite analoghi alla CU sono il Campylobacter jeunii e il Citomegalovirus (CMV) : la colite da CMV si manifesta con dolore addominale, diarrea ematica e perdita di peso.
Per quel che riguarda la MC va esclusa principalmente la Yersinia enterocolitica, che colpisce soprattutto l’ileo terminale e causa ulcerazione mucosa, invasione neutrofila e ispessimento della parete intestinale; bisogna tenere presenti anche le infezioni da micobatteri, che spesso causano un processo infiammatorio con localizzazione ileocecale e le parassitosi intestinali, soprattutto la Giardiasi che può manifestarsi con diarrea, perdita di peso e dolore addominale.
La diagnosi differenziale, inoltre, deve esser fatta con disordini di origine vascolare (la porpora di Schönlein-Henoch, la sindrome emolitico-uremica), con disordini immunitari (la Sindrome di Behçet) e, nei bambini più piccoli, l’allergia alle proteine del latte vaccino.
Altre condizioni frequenti in età pediatrica che possono porre problemi di diagnosi differenziale con le IBD, soprattutto con la MC, sono: la Sindrome dell’intestino Irritabile, l’iperplasia linfoide dell’ileo terminale, la malattia celiaca, le leucemie (che possono esordire con dolore addominale associato a diarrea muco-ematica) e altre condizioni neoplastiche (che generalmente si manifestano con febbre di origine sconosciuta e perdita di peso).
MANIFESTAZIONI EXTRA-INTESTINALI
Le IBD si associano a manifestazioni extraintestinali, il cui decorso non sempre correla con l’attività della malattia intestinale. Queste manifestazioni sono più frequenti nell’adulto che nel bambino.
L’eritema nodoso compare nel 10% dei pazienti, ed è correlato all’attività di malattia. Il pioderma gangrenoso (1-12% dei pazienti con CU, meno frequente nel MC) risulta invece non essere correlato allo stato dell’infiammazione intestinale (può non scomparire o può perfino comparire dopo proctocolectomia).
L’artrite periferica complica il 15-20% delle IBD, ed è più frequente per la malattia di Crohn. È una poliartrite asimmetrica migrante, non destruente, che colpisce le grandi articolazioni e che peggiora con le riacutizzazioni dell’infiammazione intestinale. La spondilite anchilosante colpisce circa il 10% dei pazienti con IBD. Esordisce più frequentemente intorno ai 30 anni e si associa in due terzi dei casi alla positività per l’antigene HLA-B27.
Abbastanza frequenti anche le complicanze oculari, soprattutto l’irite e l’uveite. Interessante è l’associazione con la Colangite Sclerosante: solo il 5% dei pazienti con IBD sviluppa una colangite sclerosante, mentre l’80% dei pazienti con Colangite Sclerosante Primitiva (PSC) sviluppa IBD. La PSC è caratterizzata da aumento degli indici di colestasi, in primis la Gamma-Glutamil-Transferasi (GGT) e dalla progressiva stenosi dei dotti biliari intra ed extra epatici che porta frequentemente a quadri di cirrosi biliare e insufficienza epatica nell’arco 5-10 anni.
Di notevole importanza l’anemia sideropenica. Sono stati anche descritti stati di ipercoagulabilità, con maggior rischio di malattia tromboembolica.
Altra complicanza molto frequente di queste patologie è la riduzione della mineralizzazione ossea con quadri che comprendono l’osteopenia e l’osteoporosi.
DIAGNOSI ED ESAMI STRUMENTALI
Solitamente le IBD vengono ipotizzate sulla base dei dati anamnestici e clinici. Per porre la diagnosi è comunque necessario il ricorso ad esami strumentali. Si ricorre quasi sempre ad un esame endoscopico, il quale consente di valutare il grado di infiammazione della mucosa e di effettuare prelievi bioptici multipli per l’analisi istologica. In base alla sintomatologia lamentata si sceglie tra una esofagogastroduodenoscopia (EGDS) e una colonscopia eseguita fino all’ultima ansa ileale.
Molto utili anche gli esami radiografici, a singolo (tenue seriato) e doppio contrasto (clisma opaco), che consentono di visualizzare le porzioni di intestino non raggiungibili con le indagini endoscopiche. Nella malattia di Crohn trovano largo uso anche l’ecografia delle anse intestinali (per visualizzare l’ispessimento parietale) e la risonanza magnetica (RM) con mezzo di contrasto (molto utile per studiare l’ileo terminale). La TC ha invece uno scarso ruolo, soprattutto in pediatria, a causa dell’elevato numero di radiazioni e della non superiore sensibilità rispetto alla RM.
TERAPIA MEDICA
La terapia delle IBD deve avere come obiettivi primari il controllo dei sintomi, l’induzione e il mantenimento della remissione della malattia, la prevenzione delle riacutizzazioni, e in età pediatrica assicurare un adeguato accrescimento staturo-pondero-puberale (tabella 3).
Aminosalicilati.I farmaci più largamente utilizzati nella terapia delle IBD sono gli aminosalicilati. La sulfasalazina e l’acido 5-aminosalicilico (5-ASA, mesalazina) sono antinfiammatori con spiccata attività a livello della mucosa intestinale. L’effetto principale è l’inibizione della via della lipossigenasi, con blocco della produzione di un potente fattore chemotattico, il leucotriene B4. Il dosaggio degli aminosalicilati generalmente somministrato è di 50-100 mg/kg/die.
Diversi studi hanno documentato l’efficacia della terapia con aminosalicilati, soprattutto nella CU. Meno validata è l’efficacia nel mantenimento della remissione in pazienti con MC. Gli aminosalicilati non inducono remissione endoscopica.
Gli effetti collaterali comprendono nausea, dispepsia, mialgie, ipersensibilità (più frequente con la sulfasalazina), pancreatite, epatotossicità, nefrite interstiziale e pericardite (rari).
Corticosteroidi. I corticosteroidi (prednisone e prednisolone) sono generalmente utilizzati per indurre una rapida remissione clinica nelle IBD di grado moderato-severo. Solo in una frazione di pazienti, però, questi farmaci inducono una remissione endoscopica (30-40%). Il dosaggio somministrato è generalmente di 0.5-1 mg/kg/die. Gli effetti collaterali sistemici sono notevoli, e comprendono ritenzione idrica, aumento di peso, striae rubrae, redistribuzione del grasso corporeo, ipertensione, iperglicemia, cataratta, miopatia e disturbi della sfera emozionale; di fondamentale importanza anche l’effetto sull’osso con demineralizzazione e, nel bambino, ritardo dell’accrescimento staturale. Tali effetti sono correlati alla dose e alla durata della terapia.
Antibiotici. Il ruolo centrale attribuito alla risposta del sistema immunitario alla normale flora batterica presente nel lume intestinale fornisce il razionale per l’uso degli antibiotici nella terapia delle IBD; questi , in particolare il metronidazolo, possono diminuire l’infiammazione intestinale alterando la flora batterica luminale. L’efficacia è maggiore per la malattia di Crohn (soprattutto per il tipo fistolizzante e per la malattia perianale) che per la colite ulcerosa.
Azatioprina e 6-mercaptopurina. L’azatioprina (AZA) ed il suo metabolita, la 6-mercaptopurina (6-MP), sono immunomodulatori sempre più utilizzati nella terapia delle IBD, in primo luogo per indurre la remissione clinica nei pazienti con malattia moderata-severa. Il dosaggio somministrato è di 2- 2.5 mg/kg/die di AZA e 1- 1.5 mg/kg/die di 6-MP.
Gli effetti collaterali sono quelli comuni a tutti i farmaci immunosoppressori quali leucopenia e aumentata suscettibilità alle infezioni. Si possono verificare anche ipersensibilità, pancreatite ed elevazione delle transaminasi. Frequente la nausea nel primo mese di terapia. Tra gli effetti a lungo termine il più temuto è il rischio di sviluppare linfoma. Dai dati attualmente disponibili, in pazienti pediatrici sottoposti a terapia di lunga durata, non si evidenzia nessun aumento di rischio.
Terapia nutrizionale. L’utilizzo di formule elementari (Modulen) nell’alimentazione dei bambini con malattia di Crohn si è dimostrato molto efficace non solo nel promuovere la crescita e lo sviluppo ponderale, ma anche nell’indurre una remissione sia clinica che endoscopica della malattia. Queste diete tendono a diminuire la motilità intestinale, a diminuire il carico antigenico e ad alterare la flora batterica luminale.
Farmaci biologici. I farmaci biologici, primo fra tutti l’Infliximab (IFX), sono l’ultima frontiera della terapia delle IBD. L’Infliximab è un anticorpo monoclonale chimerico anti-TNF-α, che è in grado di indurre una rapida guarigione della mucosa intestinale ed una duratura remissione clinica, endoscopica ed istologica della malattia.
L’uso dell’Infliximab è indicato in pazienti con malattia severa in fase di attività, nel MC fistolizzante e nei pazienti che non rispondono ad altre terapie. Il farmaco viene somministrato alla dose di 5 mg/kg/die, a 0, 2, 6 settimane. La terapia di mantenimento prevede un’infusione ogni 8 settimane. L’infliximab è stato utilizzato soprattutto nei pazienti con MC, ma recentemente sono stati riportati risultati incoraggianti anche nella CU.
Gli effetti collaterali possibili sono molti, primariamente dovuti alla possibile ipersensibilità al farmaco e allo stato di immunodepressione. Poiché è stata descritta un’elevata incidenza di infezione tubercolare (TBC) dopo trattamento con IFX, prima di iniziare la terapia è opportuno effettuare uno screening per TBC mediante l’esecuzione di un RX torace e dell’intradermoreazione alla tubercolina.
TERAPIA CHIRURGICA
Il ricorso alla chirurgia si rende necessario quando il controllo dei sintomi non è più soddisfacente con la sola terapia medica e in caso di complicanze (stenosi, fistole, ascessi).
La chirurgia della MC è limitata alla cura delle complicanze, resezione dei tratti stenotici e fistolosi; per la colite ulcerosa è risolutiva.


![]()
Tabella 1 – Caratteristiche anatomo-patologiche delle IBD
|
|
Colite Ulcerosa |
Malattia di Crohn |
|
|
|
|
|
Aspetti Anatomopatologici |
|
|
|
Lesioni segmentarie |
Rare |
Frequenti |
|
Aspetto ad acciottolato |
No |
Si |
|
Interessamento transparietale |
Raro |
Frequente |
|
Ascessi criptici |
Frequenti |
poco frequenti |
|
Granulomi |
Rari |
Frequenti |
|
Rischio di cancro del colon |
poco aumentato |
molto aumentato |
|
|
|
|


|
Farmaco |
Dose |
Risposta |
|
Nutrizione |
100%-130% RDA |
50-82% |
|
5-ASA |
50-100 mg/kg/die |
43-64% |
|
Prednisone |
1-2 mg/kg/die |
60-78% |
|
Budesonide |
9 mg/die |
51-62% |
|
|
|
|
|
AZA/6-MP |
AZA 2
mg/kg/die |
36-91% |
|
Infliximab |
5 mg/kg/die |
60% |
|
Placebo |
- |
8-50% |
Per la corrispondenza:
UOC di Gastroenterologia ed Epatologia Pediatrica
Università di Roma “La Sapienza”
Viale Regina Elena, 324 – 00161 Roma
Tel. 0649979326 – e-mail: marina.aloi@uniroma1.it