
La diagnosi della malattia di fegato nella sua storia naturale
A. Gasbarrini, M. Nestola, M. Siciliano, G. Bombardieri
Indagini di laboratorio
Il corretto inquadramento del paziente epatopatico, specie se in condizioni cliniche compromesse, non può naturalmente prescindere dalla valutazione di una serie di parametri generali. L’insufficenza del fegato infatti in considerazione della cruciale ruolo metabolico, sintetico e detossificante di tale organo determina modificazioni di tutti i principali parametri laboratoristici e di conseguenza altera tutte le funzioni dell’organismo fino alla conseguenza clinica terminale della “multi-organ failure (MOF)”
Gli esami laboratoristici più specificatamente atti a documentare lo stato di salute del fegato esplorano l’entità del danno epatico, la capacità sintetica, metabolica e di detossificazione epatocellulare ed, indirettamente, il grado di ipertensione portale (1, 2); tra essi distinguiamo:
· Test statici, che dosano specifici componenti bioumorali
· Test dinamici, i quali effettuano la valutazione dell’intera via metabolica a partire da un substrato noto.
Test statici
Il corretto inquadramento del paziente epatopatico, specie se in condizioni cliniche compromesse, non può naturalmente prescindere dalla valutazione di una serie di parametri generali, ma fondamentali, quali: emocromo, profilo idroelettrolitico, emogasanalisi arteriosa, parametri di funzionalità’ renale quali creatininemia, azotemia e creatinina clearance.
In particolare, in corso di epatopatia l’emocromo può aiutare ad individuarne la causa di scompenso, come nel caso di infezione o sanguinamento, ma può anche segnalare la presenza di comuni complicazioni delle fasi avanzate delle malattie epatiche, come lo stato di soppressione midollare e, l’ipersplenismo da ipertensione portale e quindi indirettamente da fibrosi epatica. Tra tutte, la piastrinopenia è la più costante delle alterazioni a carico della parte corpuscolata del sangue, talvolta nell’ambito di una pancitopenia nei casi di splenomegalia severa. Se la leucocitosi indica uno stato infiammatorio acuto e fa sospettare un processo infettivo, di fondamentale importanza e’ il dosaggio dei neutrofili nel liquido ascitico nel sospetto di una peritonite batterica spontanea. Frequente, infine, l’anemia ipocromica normocitica causata da microsanguinamenti cronici o da processi d’origine autoimmune (3).
E’ inoltre di particolare importanza la ricerca laboratoristica delle cause di epatopatia, anche attraverso un attenta anamnesi anche remota (comportamenti sessuali a rischio, uso/abuso di farmaci o tossici, emotrasfusioni…):
-virus epatotropi (marcatori specifici per HAV, HBV e virus delta, HCV, CMV, EBV, Herpesvirus)
-autoimmunita’ (marcatori specifici come AMA, SMA, ANA, LKM-1 e LKM-2)
-malattie da accumulo come emocromatosi e morbo di Wilson (determinazione di sideremia, ferritina e capacità ferro-legante, cupremia e cupruria, ceruloplasminemia)
Non ultimi sono gli esami microbiologici, specie quando si sospetta un processo infettivo, tipica causa di scompenso di una epatopatia cronica o complicanza di una epatopatia acuta. Sono da effettuarsi sia a livello ematico che dei vari distretti in cui si sospetta un focolaio d’infezione (urine, ascite...).
Esami statici specifici di funzione epatica:
-Transaminasi
Un’alterazione dei valori delle transaminasi epatiche è presente in quasi tutte le malattie del fegato. Le transaminasi, infatti, sono un indice molto valido di necrosi epatocitaria. Si avranno valori diversi a seconda se si tratta di una patologia acuta o cronica e a seconda della noxa patogena (Figura 1) (4).

Figura 1. Valori delle transaminasi in diverse malattie epatiche (Mod da Giannini EG, 2005)
In particolare, in caso di danno epatico acuto le transaminasi raggiungeranno livelli piuttosto alti. Il riscontro, per esempio, di AST >200 U/l e di ALT >300 U/l sarà espressione di danno acuto (con una sensibilità del 91% e specificità del 95% per l’AST e con una sensibilità del 96% e specificità del 94% per l’ALT) (3). Nel caso in cui tali enzimi raggiungessero valori più di 100 volte la norma, sarà giusto pensare ad un danno epatico tossico o ischemico. In particolar modo la rilevazione di AST>3000 U/l, nel 90% dei casi, è indice di una epatite tossica come quella documentata in corso da assunzione di paracetamolo (5).
Non sempre le transaminasi si innalzano in ugual modo: a tale proposito è importante tener sempre presente il rapporto AST/ALT (indice di De Ritis, dal nome del caposcuola della scuola epatologica napoletana tra le prime a riconoscere le transaminasi come indicatore di danno epatico), che raggiunge un valore superiore a 2 nell’80% dei casi di epatite alcolica (spesso accompagnato da aumento di bilirubina e fosfatasi alcalina). Infine, tale rapporto è importante anche per altre patologie epatiche (in corso di epatite non alcolica il rapporto è inferiore ad 1) e nell’evoluzione della malattia (nella cirrosi epatica tale rapporto si presenta spesso maggiore a 1) (6).
-ã-Glutamiltranspeptidasi (ã-GT)
Un aumento di ã-GT è espressione principalmente di patologie epatobiliari (ã-GT 5 volte maggiore dei valori normali in caso di alterazioni delle vie biliari). Spesso l’incremento di tale enzima è correlato ad elevati valori di fosfatasi alcalina, anche se la ã-GT è l’indicatore più sensibile in assoluto di malattie delle vie biliari. Il tentativo di associare i valori di ã-GT ad un’eziologia alcolica sono falliti, a causa della scarsa specificità di tale enzima e della sua induzione da parte di farmaci (5).
-Fosfatasi alcalina (ALP)
Nella pratica clinica, sia la colestasi intraepatica che quella extraepatica sono associate ad un incremento del valore plasmatico di fosfatasi alcalina, poiché vengono indotti sia la sintesi che il rilascio di ALP. I valori di ALP si innalzano 2-3 giorni dopo l’instaurarsi di una ostruzione biliare, e rientrano nella norma alcuni giorni dopo la risoluzione della stessa (3).
Aumenti lievi o moderati di fosfatasi alcalina possono manifestarsi in caso di cirrosi o epatite (comunque patologie epatiche parenchimali) e in caso di neoplasie metastatiche o colestatiche epatiche. Si noti che il dosaggio degli isoenzimi epatici consente di distinguere l’incremento di ALP in corso di colestasi da quello riscontrabile in altre situazioni patologiche, talvolta associate alle stesse malattie di fegato (per esempio, osteoporosi) (7).
-Altri enzimi: Lattico Deidrogenasi (LDH), 5’-Nucleotidasi, Pseudocolinesterasi, Ornitina carbamiltransferasi
-Albumina
Un aumento dei livelli serici di albumina è secondario a stati di emoconcentrazione, dovuti a disidratazione o eccessiva sudorazione. Molto più frequente è una riduzione dell’albuminemia, quasi sempre correlata ad un’alterazione della sintesi epatica e quindi ad una condizione di epatopatia (3). Esistono però condizioni morbose che possono provocare ipoalbuminemia per un’eccessiva perdita di tale proteina, in presenza di funzione sintetica epatica normale (per esempio: sindrome nefrosica, gastroenteropatie protidodisperdenti, ustioni estese). Una riduzione della concentrazione sierica di albumina può essere considerata marker di scompenso e indice prognostico negativo di epatopatia cronica avanzata. In particolare, l’albuminemia e’ uno dei parametri che costituiscono la classificazione prognostica di Child-Pugh (vedi oltre).
-Fattori della coagulazione
Altre proteine sieriche prodotte dal fegato sono i fattori della coagulazione (I, II, V, VII, IX, X, XII e XIII) (3). Qualunque condizione patologica epatica che intacchi la capacità sintetica del fegato, se grave, vede una riduzione di tali fattori e conseguentemente un’alterazione del processo coagulativo.
Il test per valutare l’efficienza coagulativa è il PT (tempo di protrombina). Quando tale valore è ridotto di più del 50% della norma c’è un elevato rischio di sanguinamento (3).
Il PT è influenzato da diversi fattori della coagulazione (V, VII, X, protrombina, fibrinogeno) e dalla vitamina K, che attiva 3 dei suddetti fattori (II, VII e X). Un prolungamento del PT è un indice molto valido di danno parenchimale epatico. Da segnalare pero’ che il PT puo’ aumentare anche in caso di ittero ostruttivo, perché una condizione di colestasi crea un malassorbimento di vitamina K.
E’ importante valutare il PT in associazione all’APTT (tempo parziale di tromboplastina attivata), espressione dell’attivazione di protrombina e dei fattori V, VII, IX, X, XI e XII; anch’esso infatti può risultare aumentato in corso di epatopatia grave.
Legato al valore PT e’ l’INR (International Normalized Ratio):
INR= (Ptpaz / Ptcontrol )ISI
dove ISI è l’indice di sensitivita’ internazionale, fattore standard per tutti i laboratori.
L’INR (o PT) e’ uno dei parametri che costituiscono le classificazioni prognostiche di Child-Pugh e di MELD (vedi oltre).
-Altre proteine seriche: Antitrombina III (ATIII), transferrina, globuline.
-Lipidi
Un danno severo del parenchima epatico spesso si associa ad aumento dei trigliceridi, riduzione degli esteri del colesterolo ed alterazione delle lipoproteine.
In caso di patologie colestatiche, invece, è tipico un aumento del colesterolo e dei fosfolipidi, associato ad un aumento dei trigliceridi. C’è poi da considerare la presenza, nel plasma, di una lipoproteina anomala, la lipoproteina X, che rappresenta un indice specifico e sensibile di colestasi.
-Ammoniaca (NH3)
Alte concentrazioni di NH3 sono presenti in caso di encefalopatia epatica acuta o cronica e nella sindrome di Reye; aumenti moderati si osservano in condizioni di epatite cronica. Tuttora è motivo di discussione la valutazione dell’ammoniemia per indicare la presenza o meno di encefalopatia epatica: molteplici, infatti, sono le situazioni in cui, pur essendoci valori di NH3 pari al doppio della norma, il paziente non può essere definito encefalopatico (8). Viceversa può esserci evidenza di encefalopatia epatica pur in presenza di normali valori ematici di ammonio (9). Numerosi sono i fattori che possono determinare in un paziente cirrotico la comparsa di encefalopatia iperammoniemica, quali ad esempio una emorragia digestiva, sepsi batterica o costipazione per un eccesso di prodotti azotati o diarrea, vomito ed eccesso di diuretici, che comportano ipovolemia
-Bilirubina
Esistono due frazioni di bilirubina:
bilirubina coniugata, la cui emivita è di 17-20 giorni
bilirubina non-coniugata, la cui emivita è inferiore a 5 minuti
L’aumento del livello serico di bilirubina si manifesta con subittero e, successivamente, ittero. L’incremento serico della bilirubina coniugata è espressione di una compromissione della secrezione di bilirubina nella bile, e, quindi, di “colestasi” intra o extraepatica; la bilirubina non coniugata aumenta in seguito all’alterazione dei processi epatocitari di coniugazione. Si eleva, pertanto, anche nei processi di emolisi, quando il fegato non riesce a coniugare la bilirubina con la stessa rapidità con cui avviene la stessa emolisi.
Una bilirubinemia >15 mg/dl è spesso espressione di danno epatico acuto severo. In tal caso il picco ematico di bilirubina si verifica dopo quello delle transaminasi e si protrae per 30+19 giorni. Successivamente la bilirubina decresce con gradualità (10).
-Altri indici di colestasi: Urobilinogeno, Acidi Biliari
-á-fetoproteina (á-FP)
Il suo aumento in età adulta nel paziente epatopatico è indice sensibile di sviluppo di epatocarcinoma (11).
Test dinamici
Il metabolismo di carboidrati, lipidi e proteine, la sintesi, l’accumulo e la secrezione di numerosi prodotti nel sangue e nella bile, la detossificazione da xenobiotici sono solo alcune delle innumerevoli funzioni del fegato. Questo spiega l’impossibilità di ottenere un test singolo capace di valutare un numero così elevato di vie metaboliche. I classici test statici biochimici forniscono infatti informazioni di danno e di funzionalità, ma nessuno di loro può essere considerato indicatore affidabile sia per quantificare la riserva funzionale epatica sia per diagnosticare l’insorgenza di complicanze di malattie epatiche acute e croniche.
Per superare queste limitazioni, nelle ultime decadi, sono stati proposti numerosi test dinamici: ciascuno di essi, esplorando una singola via metabolica, è in grado di valutare in parte la massa funzionale epatica. In particolare, sempre maggiore interesse è stato rivolto all’utilizzo di una serie di test del respiro (breath test) che utilizzano composti marcati con isotopi stabili (13C) (12).
I C-breath test sono basati sulla somministrazione di un composto in cui l’atomo 12C del carbonio posto in un gruppo funzionale della molecola è sostituito da un isotopo stabile (13C). Il gruppo funzionale, così marcato, segue la sua via metabolica fino alla trasformazione finale in *CO2. A seconda della localizzazione della tappa enzimatica limitante (rate-limiting step) del processo metabolico, il test consente di valutare l’integrità della via funzionale esplorata (13) analizzando la percentuale di 13C nell’aria espirata per mezzo di una spettrofotometro di massa a rapporto isotopico (IRMS) o una spettrometro a raggi infrarossi (14).
Numerosi e specifici 13C-breath test sono stati introdotti per una valutazione non invasiva della funzione epatica umana (Tabella 1) (15,16,17,18,19).
Substrato |
Funzione epatica |
Enzima studiato |
|
Aminopirina |
Microsomiale |
P450s (CYP1A2, 2C9) |
|
Fenacetina |
Microsomiale |
CYP1A2 (CYP2E1) |
|
Metacetina |
Microsomiale |
CYP1A2 |
|
Caffeina |
Microsomiale |
CYP1A2 (CYP2E1, 2B6) |
|
Diazepam |
Microsomiale |
CYP2C19 (CYP3A4) |
|
Eritromicina |
Microsomiale |
CYP3A4 |
|
Galattosio |
Citosolica |
Galattochinasi |
|
Fenilalanina |
Citosolica |
Idrossilasi |
|
Metionina |
Mitocondriale |
Ciclo di Krebs |
|
Acido chetoisocaproico |
Mitocondriale |
Complesso deidrogenasico degli a-chetoacidi a catena ramificata |
Tabella 1: Breath test con 13C utilizzabili per la valutazione della funzione epatica
Diagnostica strumentale non invasiva
Ultrasonografia
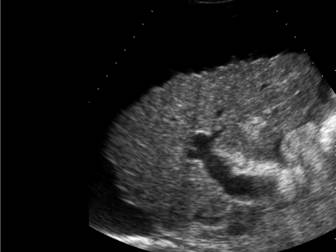
I primi elementi da valutare sono l’aspetto, le dimensioni e i margini del fegato (20,21). Colecisti e albero biliare possono presentare alterazioni di diverso grado o mostrarsi del tutto normali. Inoltre, specifiche alterazioni vascolari del fegato sono diagnosticabili tramite i soli ultrasuoni: la trombosi portale, della vena cava o delle vene epatiche (Sindrome di Budd-Chiari), le MAV. L’ecografia è inoltre strumento efficace nella valutazione dell’entità del liquido ascitico, ed e’ usata nell’individuazione di tumori primitivi e secondari del fegato (22). Indubbiamente, l’impiego più largo degli ultrasuoni riguarda il follow-up delle epatopatie croniche e delle cirrosi (23) (Figura 2). Il fegato cirrotico può apparire inizialmente irregolarmente aumentato di volume con ipertrofia di un lobo o di segmenti epatici distinti; in particolare sono comuni l’ipotrofia del lobo destro e l’ipertrofia compensatoria del lobo caudato. Inevitabilmente, con l’avanzare della malattia e della fibrosi, le dimensioni del fegato si riducono. I margini del fegato possono apparire irregolari, così come l’ecostruttura del parenchima puo’ apparire disomogenea, o grossolana (coarse liver echo-pattern) (Fig. 3). Questo aspetto è probabilmente dovuto alla presenza di steatosi e fibrosi contemporaneamente ed è da considerarsi specifico per la presenza di cirrosi.
![]()
![]()
Figura 3. Aspetto ecografico di un fegato cirrotico: coarse liver echo-pattern e margini irregolari. Si noti inoltre l’abbondante versamento ascitico (frecce)
I segni ecografici di ipertensione portale sono i seguenti:
1. Aumento di calibro della vena porta: un diametro maggiore o uguale a 13 mm è diagnostico di ipertensione portale con una specificità elevata ed una sensibilità del 50% (21, 23).
2. Riduzione della velocità media del flusso portale: all’esame eco-Doppler, una velocità di flusso portale epatopeto al di sotto del limite di 14-17 cm/sec è ritenuto un segno altamente specifico di ipertensione portale. La riduzione della velocità di flusso portale è risultata inoltre fattore predittivo per lo sviluppo di trombosi del circolo portale nei pazienti cirrotici (24).
3. Presenza di circoli collaterali: sono frequentemente evidenziati nei pazienti con ipertensione portale; sono prevalentemente localizzati a livello delle vene coronarie stomaciche, delle vene paraombelicali e a livello del territorio splenico, dove possono formarsi anastomosi splenorenali (shunt spleno-renale spontaneo).
4. Splenomegalia con diametro bipolare > 12 cm o area di sezione > 45 cm2.
Tomografia Computerizzata (TC)
La TC non è routinariamente utilizzata nello studio del paziente cirrotico fatta eccezione per la caratterizzazione delle lesioni di sospetta natura neoplastica; la sensibilità della TC per la diagnosi di epatocarcinoma è infatti superiore a quella dell’ecografia (25).
Risonanza Magnetica Nucleare (RMN)
Le indicazioni principali, al momento, sono la quantificazione del sovraccarico di ferro nell’emocromatosi e la diagnosi differenziale tra noduli displastici ed epatocarcinomi di piccole dimensioni.
Altre: Scintigrafia epatica, Fibroscan
Tecniche diagnostiche invasive
Arteriografia
Non trova indicazione nella diagnosi di cirrosi. Tre sono le sue principali indicazioni:
- Studio dell’anatomia vascolare prima di interventi chirurgici, in particolare prima del trapianto di fegato
- Chemioembolizzazione di epatocarcinoma (26).
- Valutazione della sede e dell’estensione di un’ostruzione vascolare del circolo arterioso (23).
Endoscopia
Viene eseguita routinariamente e periodicamente nei pazienti cirrotici per la valutazione e la eventuale terapia delle varici esofagee e gastriche e della gastropatia congestizia (27,28). Lo studio deve comprendere anche lo stomaco e le porzioni esplorabili del duodeno per evidenziare una gastropatia congestizia o la presenza di ulcere gastriche o duodenali.
Biopsia Epatica
La biopsia epatica è talora necessaria per determinare il grado di fibrosi ed infiammazione, effettuare diagnosi definitiva di cirrosi epatica, evidenziare eventuali accumuli di sostanze tossiche per il fegato (rame, ferro...), determinare la quantita’ di epatociti residui in caso di epatopatia acuta (29,30). L’ecografia, soprattutto, e la TC, in misura minore, sono sempre più utilizzate come guida per la puntura bioptica.
Indicatori Prognostici Complessi
L’unico approccio terapeutico in grado di modificare sostanzialmente la storia clinica e la sopravvivenza dei pazienti affetti da insufficienza epatica irreversibile è rappresentato dal trapianto di fegato; con l’uso sempre più frequente di questa procedura, si è resa necessaria l’individuazione di criteri prognostici per il singolo paziente accurati e universalmente accettati (31). Predire infatti il rischio di mortalita’ nel paziente con insufficienza epatica diviene fondamentale al fine di individuare interventi terapeutici e di allocare in modo appropriato risorse, come gli organi da trapiantare, limitate in termini numerici per lo scarso numero dei donatori o per qualita’ in considerazione del numero sempre maggiore di donatori marginali (eta’ avanzata, steatosi epatica, prolungato tempo di ischemia...).
Dal momento che, a causa delle molteplicita’ delle funzioni del fegato, non e’ mai stato identificato un singolo parametro in grado di predire l’outcome dell’insufficenza epatica sono stati messi a punto score prognostici complessi. I più comunemente usati sono quello di Child-Pugh e quello di MELD, nati, in realtà, per predire la sopravvivenza del paziente cirrotico sottoposto a shunt chirurgico porto-sistemico, procedura che in epoca pre-endoscopica e pre-TIPS era l’unico rimedio all’emorragia digestiva massiva da varici esofago-gastiche ed era gravata da una mortalita’ estermamente elevata (32).
Classificazione di Child-Pugh
Tale metodo classificativo, modificato piu’ volte negli anni, suddivide i pazienti in tre categorie di rischio sulla base di 5 parametri quali la presenza di ascite e di encefalopatia (parametri soggettivi), la concentrazione plasmatica di bilirubina e di albumina ed l’INR (parametri oggettivi) (33) (Tabella 2).
PUNTEGGIO |
1 |
2 |
3 |
|
Encefalopatia |
NO |
I-II stadio |
III-IV stadio |
|
Ascite |
NO |
Modesta |
Moderata-severa |
|
Bilirubina (mg/dl) |
< 2 |
2-3 |
> 3 |
|
Albumina (g/dl) |
> 3,5 |
2,8-3,5 |
< 2,8 |
|
INR |
< 1,7 |
1,7-2,3 |
> 2,3 |
CLASSE |
A (Tot 5-6) |
B (Tot 7-9) |
C (Tot 10-15) |
Tabella 2: Child-Pulgh Score (Mod. da Child MG, 1964)
Sebbene esso rappresenti il sistema da più tempo utilizzato, manca una sua validazione definitiva come metodo accurato per predire la prognosi del paziente con insufficienza epatica; in linea generale viene comunque riportata una sopravvivenza a 1 anno del 90% con un’aspettativa di vita di 15-20 anni per i soggetti di classe A, del 50-80% a 1 anno con un’aspettativa di vita che dipende principalmente dalla possibilità di essere sottoposto a trapianto nei soggetti di classe B, inferiore al 20% a 1 anno con un’aspettativa di vita di 1-3 anni per i pazienti di classe C (32, 34).
Oltre a questo, i limiti principali di tale metodica sono rappresentati dalla presenza nella stessa classe di malati anche molto diversi fra loro (ad esempio non distingue tra valori di bilirubinemia di 3,5 e 40 g/dl), dalla scarsa oggettività di alcuni parametri (ascite, encefalopatia) e dalla scarsa applicabilità in determinate situazioni cliniche, ad esempio nella cirrosi biliare primitiva dove l’iperbilirubinemia assume, evidentemente, un significato differente che in altre epatopatie croniche (35).
Classificazione di MELD (Model for End-stage Liver Disease)
Allo scopo di superare le limitazioni menzionate, nuovi sistemi classificativi ottenuti dalla combinazione di singoli indicatori sono stati studiati e applicati in maniera complementare alla classificazione Child-Pugh. Fra questi è oggi entrato nell’uso corrente il “Model for End-stage Liver Disease” (MELD): questo modello, messo a punto da ricercatori della Mayo Clinic di Rochester (USA) sempre con lo scopo di predire la sopravvivenza del paziente cirrotico sottoposto a shunt porto-sistemico, ha il grande vantaggio di stratificare i pazienti secondo un scala continua progressiva di severità utilizzando tre parametri oggettivabili quali la bilirubinemia, la creatininemia e l’INR (32). La formula e’ la seguente:
9.6 x loge[creat mg/dl] + 3.8 x loge[bilir 9mg/dl] + 11.2 xl ogeINR
Secondo tale sistema, viene riportata una mortalità a tre mesi superiore all’80% nei pazienti con score >30 e vicina al 100% in quelli con score >40 (32).
L’originale formula del sistema MELD ha subito diverse modifiche. Per esempio, la versione modificata da United Network for Organ Sharing (UNOS) ha lo scopo di migliorare la distribuzione degli organi da trapiantare tenendo conto anche conto del fatto che i pazienti siano o meno sottoposti a dialisi. Per pazienti al di sotto di 12 anni è utilizzato il “Pediatric Model for End-stage Liver Disease” (PELD) che tiene conto di altezza e peso del bambino.
Recentemente, infine, è stata proposa una ulteriore classificazione, che inserisce la natremia tra i parametri necessari ad attribuire il punteggio (MELD-Na). È stato infatti dimostrato che, tra i pazienti affetti da grave epatopatia in attesa di trapianto, esiste un incremento del rischio di decesso lineare con il decremento della natremia da 135 a 120 MEq/l, cosi’ da rendere il nuovo indicatore MELD-Na un più accurato predittore di sopravvivenza rispetto al classico MELD (36).
Bibliografia
1. Carlisle R et Al. The relationship between conventional liver tests, quantitative function tests, and histopathology in cirrhosis. Dig Dis Sci, 1979; 24:358-62.
2. Cotran, Kumar, Robins. Le basi patologiche delle malattie. 4a edizione italiana. Capitolo 19. Ed. PICCIN, 1992.
3. Giannini EG et Al. Liver enzyme alteration: a guide for clinicians. CMAJ, 2005; 172(3):367-79
4. Rindi G, Manni E. Fisiologia Umana. 7a Edizione,Volume II, Sezione 8a, Capitolo 39. Ed. UTET 1998.
5. Lewis GH et Al. Drug-induced liver disease. Curr Opin Gastroenterol, 2006 ; 22(3): 223-33.
6. Cortez Pinto H, Camino ME. Non-alcoholic fatty liver disease/non-alcoholic steatohepatitis (NAFLD/NASH): diagnosis and clinical course. Best Pract Res Clin Gastroenterol., 2004; 18(6): 1089-104.
7. Corazza GR et Al. Early increase of bone resorption in patients with liver cirrhosis secondary to viral hepatitis. Dig Dis Sci, 2000; 45(7): 1392-9.
8. Dufour DR et Al. Diagnosis and Monitoring of Hepatic Injury. I. Performance Characteristics of Laboratory Tests. Clin Chem, 2000; 46:2027-49.
9. Butterworth RF. Complications of cirrhosis III. Hepatic encephalopathy. J Hepatol, 2000; 32 (1 Suppl):171-80.
10. UNIGASTRO: Manuale di malattie dell’apparato digerente. Ed. Unigastro-UTET, 1998.
11. Cedrone A et Al. Utility of alpha-fetoprotein (AFP) in the screening of patients with virus-related chronic liver disease: does different viral etiology influence AFP levels in HCC? A study in 350 western patients. Hepatogastroenterology, 2000; 47(36):1654-8.
12. Armuzzi A et al. 13C breath tests for measurement of liver function. Aliment Pharmacol Ther, 2000; 11: 225-231.
13. Jalan R, Hayes PC. Review article: quantitative tests of liver function. Aliment Pharmacol Ther, 1995; 9: 263-270
14. Ramadori G, Schworer H. Does repetition of quantitative liver function tests improve prognosis accuracy of patients with cronic liver disease? Ital J Gastroenterol Hepatol, 1998; 30(3): 283-4.
15. Candelli M et Al. 13C-breath tests in the study of mitochondrial liver function. Eur Rev Med Pharmacol Sci, 2004; 8(1): 23-31
16. Nista EC et Al. 13C-breath tests in the study of microsomal liver function. Eur Rev Med Pharmacol Sci, 2004; 8(1): 33-46.
17. Merkel C et Al. Aminopyrine breath test in the prognostic evaluation of patients with cirrhosis. Gut, 1992; 33: 836-842.
18. Di Campli C et Al. Quantitative evaluation of liver function by the methionine and aminopyrine breath tests in the early stages of liver transplantation. Eur J Gastroenterol Hepatol, 2003;15(7): 727-32.
19. Ciccocioppo R et Al. Study of liver function in healthy elderly subjects using the 13C-methacetin breath test. Aliment Pharmacol Ther. 2003; 17(2): 271-7
20. Bolondi L et Al. New perspectives for the use of contrast-enhanced liver ultrasound in clinical practice. Dig Liver Dis. 2007; 39(2): 187-95
21. Busilacchi P, Rapaccini GL Ecografia Clinica. 2a edizione. Volume II, capitolo 45. Ed. Idelson-Gnocchi, 2006.
22. Rapaccini GL et Al. Hepatocellular carcinomas <2 cm in diameter complicating cirrhosis: ultrasound and clinical features in 153 consecutive patients. Liver Int, 2004; 24(2): 124-30.
23. Gasbarrini A, Nestola M et al. L’insufficienza epatica: algoritmi diagnostici e trattamenti medici, 2007; Intern Emerg Med, 2: S25-46.
24. Zocco MA et al. Reduced portal flow-rate as predictive factor of portal vein thrombosis development in patients with liver cirrhosis. DDW 2007
25. Passariello, Simonetti. Compendio di Radiologia. Ed. Idelson-Gnocchi, 2000
26. Biselli M et Al. Transcatheter arterial chemoembolization therapy for patients with hepatocellular carcinoma: a case-controlled study. Clin Gastroenterol Hepatol, 2005; 3(9): 918-25
27. Merkel C et Al. Prognostic indicators of risk for first variceal bleeding in cirrhosis: a multicenter study in 711 patients to validate and improve the North Italian Endoscopic Club (NIEC) index. Am J Gastroenterol. 2000; 95(10): 2915-20
28. Primignani M et Al. Natural history of portal hypertensive gastropathy in patients with liver cirrhosis. The New Italian Endoscopic Club for the study and treatment of esophageal varices (NIEC). Gastroenterology. 2000;119(1):181-7
29. Suriawinata AA, Thung SN. Acute and chronic hepatitis. Semin Diagn Pathol, 2006;23(3-4): 132-48
30. Lefkowitch JH. Special stains in diagnostic liver pathology. Semin Diagn Pathol. 2006 ;23(3-4):190-8
31. Oellerich M et Al. Assessment of pretransplant prognosis in patients with cirrhosis. Transplantation, 1991; 51: 801-806
32. Farnsworth N et Al. Child-Turcotte-Pugh versus MELD score as a predictor of outcome after elective and emergent surgery in cirrhotic patients. Am J Surg. 2004; 188(5): 580-3.
33. Child CG and Turcotte JG Surgery and portal hypertension. Major Probl Clin Surg, 1964. 1: 1–85
34. Huo TI et Al. Proposal of a modified Child-Turcotte-Pugh scoring system and comparison with the model for end-stage liver disease for outcome prediction in patients with cirrhosis. Liver Transpl. 2006;12(1):65-71.
35. Herold C et Al. Quantitative testing of liver function compared to prognostic scores in patients with primary biliary cirrhosis. Liver 2002, 22 (2):159-165
36. Biggins SW et Al. Evidence based incorporation of serum sodium concentration into MELD. Gastroenterology, 2006; 130 86): 1652-60
Approccio terapeutico e nuove frontiere nel trattamento del danno epatico
A. Gasbarrini, M. Nestola, M. Siciliano, G. Bombardieri
In corso di insufficienza epatica severa, eventualmente in attesa dell’organo disponibile per il trapianto, risulta cruciale l’ottimizzazione del trattamento medico, capace di ridurre del 20% la mortalita’ (1). I pazienti richiedono un pronto monitoraggio, riequilibrio e mantenimento dei parametri vitali: le Unità di Terapia Subintensiva Epatologica (Liver Unit), meglio se connesse con un Centro Trapianti di fegato, sono le unita’ che meglio sono in grado di fornire i mezzi necessari a questo scopo. La pressione sanguigna arteriosa come quella venosa, la pressione endocranica, il livello dei gas disciolti nel sangue e la diuresi infatti devono essere costantemente controllati e corretti, anche attraverso l’uso di metodi invasivi (cateteri vascolari, cateteri urinari, cateteri liquorali, intubazione orotracheale, etc…).
Il trattamento intensivo di questi pazienti oggi comincia inoltre a disporre di supporti artificiali da utilizzare come ponte al trapianto o come metodiche di rigenerazione epatocitaria. In vari centri infatti sono disponibili metodiche di depurazione come la plasmaferesi o di adsobimento tramite albumina come il MARS od il Prometeus.
Nell’insufficienza epatica acuta e nelle fasi di scompenso acuto di un’epatopatia cronica, alcune procedure terapeutiche possono consentire il superamento della fase di emergenza ed, eventualmente, posticipare il momento di inserimento in lista trapianto. Fatta eccezione per i pochissimi casi in cui esiste una possibilità terapeutica curativa reale (es. N-acetil-cisteina nelle intossicazioni da paracetamolo), la terapia medica si rifà a principi generali ed alla prevenzione e al trattamento delle complicanze: ascite, sepsi, encefalopatia epatica, sanguinamento gastrointestinale, sindrome epato-renale (SER) (2). Non vi è spazio, nella presente trattazione, per una descrizione completa ed esaustiva dell’argomento, per la quale si rimanda alla consultazione delle relative linee guida proposte dall’Associazione Italiana per lo Studio del Fegato (AISF) (www.webaisf.org).
Principi generali
- Evitare i fattori eziologici o aggravanti (alcool, farmaci, ecc) e trattare eventuali farmaco-dipendenze (2,3)
- Individuare e curare precocemente infezioni batteriche con antibioticoterapie mirate
- In caso di sovrapposizione Ä o sviluppo di ceppo HBV mutante resistente in pazienti già in terapia antivirale anti-HBV, e comunque in tutti i pazienti che presentino una infezione virale, adeguare la terapia
- Riposo a letto: in caso di febbre, infezioni, deterioramento della funzionalità epatica, in particolare in caso di ascite
- Dieta: introito calorico tra 1900 e 3000 Kcal/die a seconda dello stato nutrizionale e del fabbisogno calorico del paziente. Il contenuto di proteine va ridotto unicamente se insorgono segni di encefalopatia porto-sistemica. In tale caso, la maggior parte delle calorie deve essere somministrato sotto forma di carboidrati. Una restrizione del sale (<4 gr/die) solo se si sviluppa ritenzione idrica (4)
- In caso di colestasi: colestiramina cloridrato (8-16 mg/die), acido ursodeossicolico (fino 15-25 mg/kg/die); nelle forme intrattabili: rifampicina (150-300 mg x2/die), antagonisti dei recettori per gli oppioidi (naloxone, naltrexone)
- Complessi di vitamine idro e lipo-solubili quando necessario. In particolare, vitamina K in caso di ipoprotrombinemia (20 mg x 3 per os, 20 mg x 1-2 per via i.m.)
- Emoderivati in caso di sanguinamenti (vedi oltre) e CID
- Fondamentale, infine, e’ evitare farmaci epato, nefro e gastro-tossici (FANS, antibiotici..) quando non assolutamente necessario ed evitare brusche modificazioni del volume plasmatico.
Ascite
Misure non farmacologiche:
- Riposo a letto
- Restrizione sodica, sebbene i pazienti con funzione renale conservata non beneficino di tale trattamento.
- Restrizione idrica in caso di iposodiemia (<125 mEq/L).
Misure farmacologiche:
- Diuretici antialdosteronici (spironolattone, canrenoato di potassio) (5) alle dosi di 50-600 mg/die. Sono i farmaci di prima scelta. L’obiettivo della terapia diuretica deve essere una perdita di peso di 0.5-1 Kg/die in caso di ascite accompagnata da edema periferico, di 0.250 kg/die se sia presente la sola ascite. In caso di mancata risposta dopo 4-5 giorni, associare:
- Diuretici tiazidici (es. idroclorotiazide, 25-50 mg) o dell’Ansa (furosemide, 25-150 mg). I diuretici vanno evitati o sospesi in caso di incremento degli indici di funzionalità renale, per il rischio di sindrome epato-renale, o se compaiono segni di encefalopatia porto-sistemica (6). Con la farmacoterapia d’associazione si ottiene una risposta nel 90% dei pazienti, e in tali casi va diminuita gradualmente fino a raggiungere il dosaggio minimo che consenta al paziente di mantenere il peso stabile (7). In caso di mancata risposta dopo 4-5 giorni o controindicazioni o complicanze legate all’uso dei diuretici si procedera’ tramite:
- Paracentesi evacuativa, seguita da infusione e.v. di albumina (6-8 g/l di ascite evacuata) o altri plasma expanders (Emagel, Destano) (8). Le paracentesi ripetute sono da eseguire solo nei pazienti con ascite refrattaria e con ascite tesa poco responsiva.
Un cenno meritano i trattamenti invasivi che si rendono necessari nei casi di ascite refrattaria, definita dalla mancata risposta alla corretta terapia medica (dieta iposodica, antialdosteronico fino 500-600 mg e furosemide fino 150 mg/die) o dalla necessità di sospenderla per la comparsa di effetti collaterali:
- TIPS (Shunt porto-sistemico trans giugulare) (9)
- Anastomosi porta-cavale: nei casi intrattabili con TIPS e sanguinamento digestivo intrattabile da ipertensione portale
- Trapianto di fegato
Peritonite batterica spontanea (PBS)
La peritonite batterica spontanea (PBS) è l’infezione del liquido ascitico in assenza di cause intra addominali primitive e di altre infezioni sistemiche (endocardite, broncopolmonite..). Il criterio minimo per definire la PBS è la conta di neutrofili> 250/mm3. Il trattamento si avvale di antibiotici ad ampio spettro (Cefotaxime, Ceftriaxone, Amoxicillina+Acido Clavulanico, Norfloxacina, Ciprofloxacina..) (4,10).
Encefalopatia epatica
Puo’ essere scatenata da emorragie intestinali, errato uso di diuretici e/o sedativi, ipopotassiemia e alcalosi, eccessiva introduzione di proteine, stipsi, infezioni, TIPS o anastomosi porta-cava, aggravamento dell’epatopatia e della nefropatia (11).
Il suo trattamento si avvale spesso di una nutrizione parenterale a basso contenuto proteico, povera di aminoacidi aromatici, ricca di vitamine e ad alto contenuto calorico. Utile l’uso di aminoacidi non aromatici (a catena ramificata), che non contribuendo alla sintesi di falsi trasmettitori, non interferiscono con la sintomatologia cerebrale (12,13).
Si considera inoltre, nel tentative di ridurre l’assorbimento proteico intestinale l’uso di:
- Lattulosio a dosaggio adeguato: fino a determinare 2-3 evacuazioni/die. Agisce velocizzando il transito intestinale e favorendo lo sviluppo di flora saccarolitica rispetto a quella proteolitica.
- Antibiotici non assorbibili (neomicina, rifaximina..)
- Antibiotici sistemici (metronidazolo, chinolonici..)
Emorragie digestive
Prevenzione e terapia della rottura delle varici esofagee e gastriche
L’algoritmo della prevenzione del primo evento emorragico da varici è nel seguente schema (mod. da Ideo G, 2005) (14):
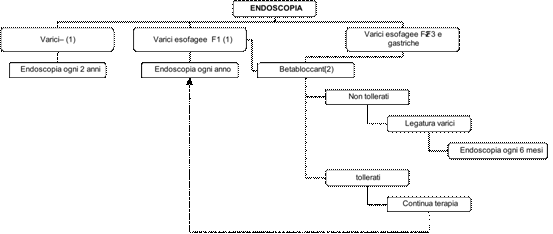
(1) Sudi in corso valutano l’efficacia di beta-bloccanti e diuretici nella prevenzione della comparsa delle varici e nel rallentamento della progressione. È stato osservato che il Nadololo in pazienti con piccole varici ne rallenta la progressione (15)
(2) Propanololo (20-40 mgx2/die oppure Nadololo (40-80 mg/die) da soli o associati a nitroderivati (16)
Nel 90% dei pazienti cirrotici un sanguinamento acuto origina dalla varici esofagee e la mortalità conseguente a tale complicanza resta tutt’oggi elevata (30%) (17). La rottura delle varici gastriche rappresenta il 5-10% dei sanguinamenti da varici (18). Nello schema seguente viene suggerito l’algoritmo della terapia del sanguinamento e della prevenzione del risanguinamento (4,19).

(1) Oltre all’uso di fluidi, emoderivati, plasma expanders, si sono rivelati fondamentali i farmaci vasoattivi capaci di ridurre il flusso ematico (20):
Terlipressina 500 ìg in bolo e.v. ogni 4-6 ore
Somatostatina 250 ìg in bolo seguiti da 250 ìg/h in i.c. per 4-5 giorni.
Octreoide 50 ìg in bolo e 50 ìg/h in i.c. per 2-3 giorni
(2) Per prevenire la nuova rottura di varici, si esegue (16):
· Continuazione della legatura o della scleroterapia fino all’eradizazione delle varici
· Trattamento a lungo con beta-bloccanti soli o associati a isosorbide mononitrato
· In casi selezionati, ad esempio, nei pazienti con discreta funzionalità epatica a fronte di grave ipertensione portale e varici non controllabili, si può scegliere di effettuare lo Shunt porto-sistemico trans giugulare (TIPS) (vedi oltre), e, se non efficace, l’approccio chirurgico: anastomosi porta-cava latero-laterale, spleno-renale distale (sec. Warren), transezione esofagea con devascolarizzazione gastrica
· Trapianto di fegato
(3) La TIPS permette di controllare con successo emorragie da rottura di varici esofagee e gastriche e i sanguinamenti da gastropatia congestizia. Nel 25% dei casi compare encefalopatia, mentre nel 50% dei casi lo stent va incontro a obliterazione (21).
Prevenzione e terapia della gastropatia ipertensiva
Rappresenta circa il 2-3% delle cause di emorragia digestiva nel paziente cirrotico. La prevenzione del sanguinamento si effettua mediante l’uso dei â-bloccanti associati o meno ai nitroderivati (22). La terapia dell’emorragia si avvale dei farmaci vasocostrittori menzionati, e, eventualmente della TIPS (22). L’unico trattamento definitivo, resta, anche in questo caso, il trapianto.
Sindrome Epato-Renale
È un’alterazione renale funzionale in corso di malattia di fegato acuta o cronica, causata dalle alterazioni emodinamiche proprie della malattia (23,24,25,26). La più frequente causa è la peritonite batterica spontanea. I criteri di diagnosi di SER sono nella tabella 1 (27).
La prognosi è in genere negativa. Il primo intervento è la correzione della volemia nei pazienti con perdita di fluidi per via renale o intestinale e sanguinamento: oltre alla sospensione dei diuretici sono utilizzati emoderivati e plasma-expanders. Controverso è l’uso di Dopamina a basse dosi (1-3 ìg/kg/min in infusione continua) in grado, com’è noto, di indurre vasodilatazione renale, associata a furosemide (28). Infatti uno studio multicentrico randomizzato controllato contro placebo su 324 pazienti ha indicato che l’uso di dopamina a dosi “renali” non migliora la funzionalità renale né incide sulla necessità del trattamento dialitico (29). Secondo altri, la terapia con dopamina a basse dosi sarebbe comunque in grado, nei pazienti cirrotici, di accentuare la vasodilatazione splancnica e aumentare l’ipertensione portale (30). Di recente utilizzo è l’associazione: Plasma, albumina (20-60 g/die) e ornipressina (2-6 UI7h e.v.) o terlipressina (0.5-2mg/4 h ev) (31). I risultati sono modesti. Lo scopo è quello di mantenere un minimo miglioramento della funzionalità renale fino al trapianto. Impiegati, in casi selezionati, lo shunt peritoneo-venoso e la TIPS (32).
La prevenzione della SER avviene mediante: adeguata terapia diuretica associata a plasma expanders, specie se si effettuano paracentesi, trattamento e prevenzione dei sanguinamenti digestivi, trattamento e prevenzione delle infezioni, in particolare della peritonite batterica spontanea (33,34).
|
Criteri dell’International Ascitis Club: 1.pazienti con insufficienza epatica e ipertensione portale 2.creatininemia>1.5 mg/dl o creatinina clearance < 40 ml/min, assenza di shock, infezioni batteriche, trattamenti epatotossici 3.assenza di perdita di liquidi per via gastrointestinale o renale 4.mancato miglioramento della funzionalità renale dopo sospensione dei diuretici e l’espansione plasmatica 5.proteinuria<500 mg/die 6.assenza di alterazioni ecografiche delle vie urinarie
|
|
Criteri addizionali: i. diuresi <500m ml/die ii. sodio urinario <10mEq/l iii. osmolarità urinaria > osmolarità plasmatica iv. ematuria <50 emazie/campo v. sodio plasmatico <130mEq/l.
|
Tabella 1: Criteri diagnostici della Sindrome Epato-Renale (mod. da Arroyo V, 1996) (83)
Prospettive terapeutiche future
Metodiche di supporto artificiale
Avere un supporto epatico artificiale simile alla dialisi per il rene e’ una chimera che gli epatologi seguono da decenni. Il fegato e’ però organo dotato di funzioni complesse e molteplici e ad oggi ogni supporto non ha dato i risultati sperati. Un modello “ideale” di fegato artificiale, infatti, dovrebbe garantire tutte le funzioni epatiche deficitarie, ed avere caratteristiche di sicurezza, economicita’ e maneggevolezza. I sistemi totalmente artificiali mancano della funzione metabolica, d’altro canto quelli bioartificiali, che, cioè, si avvalgono di componenti biologici, oltre a non aver dimostrato una maggiore efficacia, sono meno sicuri, più costosi e richiedono una struttura molto più complessa per poter essere prodotti ed utilizzati (35).
Il “fegato artificiale” oggi maggiormente utilizzato prende il nome di “Molecular Adsorbent Recirculating System” (Gambro, Germany) meglio conosciuto con l’acronimo “MARS”; esso e’ distribuito in diversi paesi di Europa, Asia e Americhe con oltre 7000 pazienti trattati per un totale di circa 30000 trattamenti eseguiti. Si tratta di un sistema extracorporeo che, combinando le proprietà di dialisi, filtrazione ed adsorbimento, e’ in grado di rimuovere sia tossine idrosolubili libere che liposolubili circolanti legate a molecole di trasporto prima fra tutte l’albumina (Figura 1) (36,37).
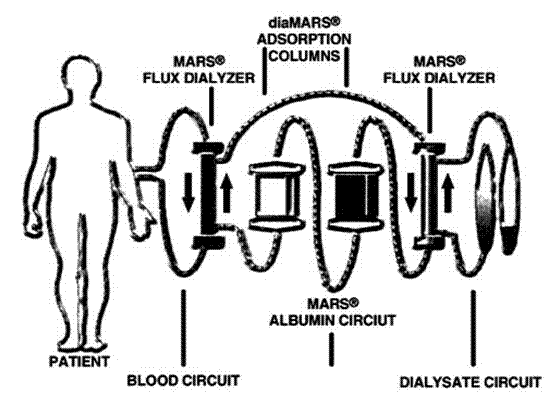
Figura 1. Schema di funzionamento del MARS (Mod.da www.mars-dialyse.de/e/index.htm)
Ad oggi la condizione in cui l’uso del MARS sembra avere un ruolo è la colestasi severa associata a encefalopatia e/o sindome epato-renale non rispondenti a terapia medica standard. Tale condizione clinica si verifica in corso di insufficienza epatica acuta, insufficienza acuta su epatopatia cronica, mancata ripresa funzionale di fegato trapiantato. Inoltre, il MARS ha dimostrato essere particolarmente efficace nell’intossicazione da farmaci e tossici (indicazione per cui il MARS ha ottenuto nel maggio 2005 l’approvazione presso la Food and Drug Administration (FDA) negli Stati Uniti) e nel prurito intrattabile delle malattie colestatiche.
In generale, tutti gli autori riportano una grande capacità depurativa della metodica nei confronti di molecole idro- e liposolubili di piccole e medie dimensioni; questo si riflette: in una netta riduzione dei valori serici di acidi biliari, bilirubina, ammonio, citochine proinfiammatorie, ossido nitrico, creatinina, azoto ureico; nel riequilibrio acido/base; nella correzione dello sbilanciamento tra aminoacidi aromatici ed aminoacidi a catena ramificata. Clinicamente è stato osservato un significativo miglioramento del grado di encefalopatia epatica e del prurito; inoltre, in alcune serie cliniche il MARS si è dimostrato utile nel trattamento della sindrome epatorenale, nella stabilizzazione del quadro emodinamico e secondo alcuni ha permesso una debole ripresa delle capacità di sintesi del fegato.
Rari sono gli effetti collaterali severi relativi alla metodica: coagulopatia verosimilmente correlata ad un consumo di piastrine; ipotensione arteriosa nelle prime ore di trattamento, ipoglicemia ed edema polmonare di origine non cardiaca.
Da segnalare però che mancano ancora studi controllati contro terapia medica standard su casistiche adeguate e che la maggior parte degli studi proviene da singoli centri e da casistiche nonadeguate e da poloazioni eterogenee di pazienti.
Nell’esperienza condotta nel nostro centro dal 2000 ad oggi, i pazienti selezionati per ricevere il trattamento MARS hanno mostrato un miglioramento dei parametri biochimici, della funzione neurologica e del prurito, sebbene la sopravvivenza sia stata comunque correlata all’esecuzione o meno del trapianto (36). Interessante l’osservazione che la prognosi sia risultata correlata alla riduzione dei livelli delle citochine infiammatorie determinata dal trattamento stesso (37,38).
Medicina Rigenerativa
L’uso di cellule staminali o fattori di crescita potrebbe essere un’opzione futura per stimolare la rigenerazione e la ripopolazione del parenchima epatico, così da fornire una metodica alternativa per la ripresa funzionale del fegato (39,40,41). Nonostante manchino dati definitivi da studi clinici e la maggior parte delle informazioni provengano da studi su animale, le possibili applicazioni date dalla medicina rigenerativa propongono soluzioni affascinanti e auspicabili al piu’ presto, anche in ambito epatologico.
Bibliografia
1. De Gasperi A. Insufficienza epatica acuta: cure intensive e monitoraggio. International Continuing Education Course in Clinical Toxicology, 2004.
2. De Franchis R. Dell’Era A. Non-invasive diagnosis of cirrhosis and the natural history of its complications. Best Pract Res Clin Gastroenterol, 2007; 21(1): 3-18.
3. Addolorato G. et Al. Baclofen: a new drug for the treatment of alcohol dependence. Int J Clin Pract. 2006; 60(8): 1003-8.
4. Gasbarrini A, Nestola M et al. L’insufficienza epatica: algoritmi diagnostici e trattamenti medici, 2007; Intern Emerg Med, 2: S25-46.
5. Bolondi L et Al.; DOC Study Group. Effect of potassium canrenoate, an anti-aldosterone agent, on incidence of ascites and variceal progression in cirrhosis. Clin Gastroenterol Hepatol. 2006 ;4(11):1 395-402.
6. Arroyo V et Al. Definition and diagnostic criteria of refractory ascites and hepatorenal syndrome in cirrhosis. Hepatology, 1996; 23: 164-76
7. Bernardi M et Al. Study of renal function, renin-aldosterone axis and plasma electrolytes durino diuretic treatment of patients with cirrhosis of the liver. Ital J Gastroenterol 1982; 14: 199-204
8. Romanelli RG et Al. Long-term albumin infusion improves survival in patients with cirrhosis and ascites: an unblinded randomized trial. World J Gastroenterol. 2006; 12(9): 1403-7.
9. Dionigi R. Chirurgia. 2a edizione. Sezione 10, capitolo 11. Ed. Masson, 1999.
10. Ghassemi S, Garcia-Tsao G. Prevention and treatment of infections in patients with cirrhosis. Best Pract Res Clin Gastroenterol, 2007; 21 (1) 77-93.
11. Goldman, Benntt. Cecil: trattato di medicina interna. 21a edizione. Parte XII, capitolo 153. Ed. Verducci, 2001.
12. Rossi Fanelli F, Cangiano C. Branched-chain amino acids in chronic liver failure: good friends or hated enemies? Nutrition,1990; 6(5): 414-5.
13. Rossi Fanelli F et Al. Branched-chain amino acids vs lactulose in the treatment of hepatic coma: a controlled study. Dig Dis Sci, 1982; 27(10): 929-35.
14. Ideo G. Compendio di Epatologia. 2005
15. Merkel C et Al.; Gruppo Triveneto per l’Ipertensione Portale. A placebo-controlled clinical trial of nadolol in the prophylaxis of growth of small esophageal varices in cirrhosis. Gastroenterology, 2004;127(2):476-84
16. Bosch J et Al. . Current management of portal hypertension. J Hepatol. 2003;38 Suppl 1:S54-68
17. Zakim D, Boyer TD. Hepatology: a textbook of liver disease. Ed. Saunders, 1996.
18. D’Amico G, De Franchis R; Cooperative Study Group. Upper digestive bleeding in cirrhosis. Post-therapeutic outcome and prognostic indicators. Hepatology, 2003; 38(3): 599-612
19. Dib N et Al. Current management of the complications of portal hypertension: variceal bleeding and ascites. CMAJ. 2006 May 9;174(10):1433-43
20. D’Amico G. The role of vasoactive drugs in the treatment of oesophageal varices. Expert Opin Pharmacother. 2004; 5(2): 349-60
21. Ferguson JW, Hayes PC. Transjugular intrahepatic portosystemic shunt in the prevention of rebleeding in oesophageal varices. Eur J Gastroenterol Hepatol. 2006;18(11):1167-71
22. Zaman A. Portal hypertension-related bleeding: management of difficult cases. Clin Liver Dis. 2006;10(2):353-70
23. Bernardi M et Al. Hepatorenal disorders: role of the renin-angiotensin-aldosterone system. Semin Liver Dis, 1994 ; 14(1): 23-34.
24. Bernardi M et Al. Renal sodium retention during upright posture in preascitic cirrhosis. Gastroenterology, 1993; 105(1):188-93.
25. Blendis L et Al. The natural history and management of hepatorenal disorders: from pre-ascites to hepatorenal syndrome. Clin Med, 2003; 3(2): 154-9
26. Moreau R, Lebrec D. Diagnosis and treatment of acute renal failure in patients with cirrhosis. Best Pract Res Clin Gastronterol, 2007; 21 (1): 111-23
27. Arroyo V. et Al. Definition and diagnostic criteria of refractary ascites and hepatorenal syndrome in cirrhosis. International Ascites Club, Hepatology, 1996; 23: 164-76.
28. Arroyo V et Al. Ascites and hepatorenal syndrome in cirrhosis: pathophysiological basis of therapy and current management. J Hepatol, 2003; 38 suppl 1: S69-89.
29. Australian and New Zealand intensive Care Society (ANZICS) Clinical Trial Group. Low dose dopamine in patients with early renal dysfunction: a placebo-controlled randomised trial. Lancet, 2000; 356:2139-43
30. Bacq Y et Al. Systemic, splancnic and hemodynamic effects of a dopaminergic dose of dopamine in patients with liver cirrhosis. Hepatology 1991; 14:483-87.
31. Uriz J et Al. Terlipressin plus albumin infusion: and effective and safe therapy of hepatorenal syndrome. J hepatol, 2000; 33:43-48
32. Wong RF et Al. Midodrine, Octreoide, Albumin and TIPS in selected patients with cirrhosis and type 1 hepatorenal syndrome. Hepatology 2004; 40:55-64
33. Gentilini P et Al. Hemodynamic derangement and cardiac dysfunction in cirrhosis. Ann Ital Med Int. 2004;19(2): 90-7
34. Trevisani F et Al. Circadian variation in renal sodium and potassium handling in cirrhosis. The role of aldosterone, cortisol, symapathoadrenergic tone and intratubular factors. Gastroenterology 1989; 6: 1187-98
35. Rozga J. Liver support technology--an update. Xenotransplantation. 2006; 13(5):380-9
36. Gaspari R et Al. Molecular adsorbent recirculating system in liver transplantation: Safety and efficacy. Transplant Proc, 2006; 38(10): 3544-51.
37. Di Campli C et Al. Catholic university experience with molecular adsorbent recycling system in patients with severe liver failure. Transplant Proc, 2005; 37(6): 2547-50.
38. Di Campli C et Al. The decrease in cytokine concentration during albumin dialysis correlates with the prognosis of patients with acute on chronic liver failure. Transplant Proc. 2005; 37(6): 2551-3.
39. Gasbarrini A et Al. Rescue therapy by portal infusion of autologous stem cells in a case of drug-induced hepatitis, Dig Liver Dis. 2006. In press.
40. Piscaglia AC et Al. How does human stem cell therapy influence gene expression after liver injury? Microarray evaluation on a rat model. Dig Liver Dis, 2005; 37(12): 952-63
Di Campli C et Al. Improvement of mortality rate and decrease in histologic hepatic injury after human cord blood stem cell infusion in a murine model of hepatotoxicity. Tr